高锰酸钾(KMnO4)是一种常用的氧化剂。I.(1)有下列变化: 找出其中一个变化与“”组成一个反应
| 高锰酸钾(KMnO4)是一种常用的氧化剂。 I.(1)有下列变化: 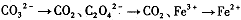 ,找出其中一个变化与“ ,找出其中一个变化与“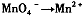 ”组成一个反应,写出该反应的离子方程式____ 。 ”组成一个反应,写出该反应的离子方程式____ 。(2)不同条件下高锰酸钾可发生如下反应: 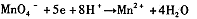 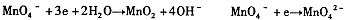 由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。 由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。(3)高锰酸钾溶液与硫化亚铁有如下反应: 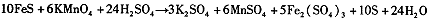 若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为 个。 Ⅱ.酒后驾车已成为一个社会问题。检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种。 (4)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC: 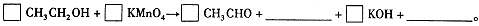 完成并配平上述反应。 (5)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,该反应的化学方程式为____ 。 |
参考解答
| 14分 ⑴2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O (3分) ⑵溶液酸碱性 (2分) ⑶0.1NA (6.02×1022) (3分) ⑷3CH3CH2OH+2KMnO4=3CH3CHO+2MnO2+2KOH+2H2O (3分) ⑸I2O5+5 CH3CH2OH→I2+5CH3CHO+5H2O (3分) |
试题分析:⑴“MnO4-→Mn2+”是还原,那么另一过程必定是氧化,故只有“C2O42-→CO2”合题意,方程式为2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O。 ⑵由条件中的三个半反应可知是溶液酸碱性。 ⑶由化学方程式可得关系式:10FeS ~ 10S ~ Δm(固)~ 转移e- 880g 320g 560g 20mol 2.8g ∴0.1mol 转移电子数目为0.1NA (或6.02×1022)。 ⑷由于反应生成了碱,根据第⑵题可知KMnO4被还原为MnO2,故方程式为: 3CH3CH2OH+2KMnO4=3CH3CHO+2MnO2+2KOH+2H2O ⑸用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,那么I2O5就被还原为I2。 I2O5+5 CH3CH2OH→I2+5CH3CHO+5H2O |
相似问题
氮及其化合物与我们的吃 穿 住 行 健康等都有着密切的联系 也是高中化学学习中重要的一部分。请回答下
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:I.(1)现有一支15mL的试管,充满NO
(8分)稀HNO3和锌反应的化学方程式如下:4Zn + 10 HNO3= 4Zn(NO3)2 +N2
(8分)稀HNO3和锌反应的化学方程式如下:4Zn + 10 HNO3= 4Zn(NO3)2 +N2O↑+5H2O (1)请标明上述化学方程式中电子转移的方向和数目。(2)该反应中还原
高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去。水体呈弱酸性时 高
高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去。水体呈弱酸性时,高锰酸钾的还原产物是MnO和MnO2,且MnO和MnO2的
标准状况下 将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(S
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0 2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的B
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+C
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH="-574" kJ·mol-1②CH4(g)+4NO(g)=2N2(g)












