标准状况下 将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(S
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3 g。则下列关于该过程的推断不正确的是
|
参考解答
| A |
试题分析:将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。主要发生了:1、二氧化硫与氯气在水溶液中的氧化还原反应且两者按物质的量之比1:1进行;2、由于溶液的棕黄色变浅,知前者反应物二氧化硫过量继而发生了二氧化硫与三价铁离子的氧化还原反应,且二者按物质的量之比1:2进行。再据向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3 g,知沉淀为硫酸钡且是 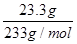 =0.1摩尔,故C正确;同时知溶液中硫酸根总量为0.1摩尔,其中来自于硫酸铁0.06摩尔,那么另外0.04摩尔硫酸根肯定来自于二氧化硫的氧化产物,由此推知有0.04摩尔二氧化硫被氧化,故B正确;当溶液中所有的三价铁离子全部被还原时,(即0.04摩尔三价铁)需要二氧化硫0.02摩尔,那么其余0.02摩尔二氧化硫参与了和氯气的反应,并消耗氯气0.02摩尔,故A错误;这样看来a L混合气体的物质的量为0.08mol时,即1.792升时反应恰好完成,只要二氧化硫大于0.06摩尔即混合气体体积大于1.344升时即合题意,D正确。 =0.1摩尔,故C正确;同时知溶液中硫酸根总量为0.1摩尔,其中来自于硫酸铁0.06摩尔,那么另外0.04摩尔硫酸根肯定来自于二氧化硫的氧化产物,由此推知有0.04摩尔二氧化硫被氧化,故B正确;当溶液中所有的三价铁离子全部被还原时,(即0.04摩尔三价铁)需要二氧化硫0.02摩尔,那么其余0.02摩尔二氧化硫参与了和氯气的反应,并消耗氯气0.02摩尔,故A错误;这样看来a L混合气体的物质的量为0.08mol时,即1.792升时反应恰好完成,只要二氧化硫大于0.06摩尔即混合气体体积大于1.344升时即合题意,D正确。 |
相似问题
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+C
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH="-574" kJ·mol-1②CH4(g)+4NO(g)=2N2(g)
下列反应中 盐酸既作还原剂 又表现出酸的性质的是A.B.C.D.
下列反应中,盐酸既作还原剂,又表现出酸的性质的是A.B.C.D.
在加热时 浓硫酸与铜发生反应的化学方程式为:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2
在加热时,浓硫酸与铜发生反应的化学方程式为:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是A.是氧化还原反应B.浓硫酸是
对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN-+8OH-+5Cl2=2CO2+N2+10C
对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O。下列判断正确的是A.当有0 2mol CO2生成时,溶液中阴
(5分)用KClO3和浓盐制取消毒剂二氧化氯的方程式如下: KClO3+ HCl → KC
(5分)用KClO3和浓盐制取消毒剂二氧化氯的方程式如下:KClO3+HCl → KCl+ClO2↑+Cl2↑+( )(1) 请完成该化学方程式并配平(未知物填入括号内,












