氮及其化合物与我们的吃 穿 住 行 健康等都有着密切的联系 也是高中化学学习中重要的一部分。请回答下
| 氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题: I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 。  (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
①恒温恒容下,平衡时NH3的转化率甲 乙。(填“>”、“=”、或“<”) ②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x= ,y= ,z= . (3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)  N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。 N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。A.大于 B.小于 C.等于 D.以上都有可能 (4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是 。 Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题: (1)写出该反应的化学方程式: 。反应过程中,氧化剂和还原剂物质的量之比为 。 (2)若反应中生成0.2mol HNO3,转移的电子数目为 。 |
参考解答
| 14分)Ⅰ.(10分)(1)9mL和14.25mL(2分) (2)①>(1分) ② 1,0.8,1.2(各1分) (3)D(2分) (4)c(NO-3)>c(H+)>c(NH+4)>c(OH-)(2分) Ⅱ . (4分) (1)3NF3+5H2O=9HF+2NO+HNO3(2分) 2:1 (1分) (2)2.408×1023 或0.4NA(1分)(写成物质的是不给分) |
试题分析:I.(1)4NO+3O2+2H2O=4HNO3,剩余气体3mL,过量气体可能是O2或NO,若是O2过量,NO全部参加反应,根据4NO~3O2,V(O2)=  +3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)= +3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)= 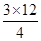 =9mL; =9mL;(2)①恒温恒容,乙中投料是甲中投料的4倍,等同于增大压强,平衡逆向移动,因此甲>乙; ②根据等效平衡可知,丙中转化为起始量与甲中的起始量相同,则 4NH3(g)+5O2g)?4NO(g)+6H2O(g), 起始1 2 丙 0.2 x y z 则0.2+y=1, x +  y =2 z = y =2 z = 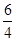 y y解得y =0.8,x=1,z=1.2; (3)恒温恒容下反应相同时间,T1<T2,两个密闭容器中分别充入等量NO2,在T1下,达到平衡时,所用时间为t1,在T2时,在t1时间时已达到平衡,因为升高温度,平衡逆向移动,所以a1>a2,选择时间小于t1,在相同时间内,在T2时,尚未达到平衡,反应正向移动,则有a1小于或等于a2,故答案为:D; (4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,得到硝酸铵和硝酸的混合溶液,且二者物质的量相等,二者中都含有NO3-,它浓度最大,NH4+水解,因此C(H+)>C(NH4+),C(OH-)最小,c(NO-3)>c(H+)>c(NH+4)>c(OH-); Ⅱ.3NF3+5H2O=9HF+2NO+HNO3,NF3既是氧化剂又是还原剂,其中N化合价是+3价,体现氧化性有2mol降到+2价,体现还原性有1mol升到+5价,氧化剂和还原剂物质的量之比为2:1,反应中每有1mol硝酸生成,转移电子2mol,若反应中生成0.2mol HNO3,转移的电子数目为0.4NA。 |
相似问题
(8分)稀HNO3和锌反应的化学方程式如下:4Zn + 10 HNO3= 4Zn(NO3)2 +N2
(8分)稀HNO3和锌反应的化学方程式如下:4Zn + 10 HNO3= 4Zn(NO3)2 +N2O↑+5H2O (1)请标明上述化学方程式中电子转移的方向和数目。(2)该反应中还原
高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去。水体呈弱酸性时 高
高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去。水体呈弱酸性时,高锰酸钾的还原产物是MnO和MnO2,且MnO和MnO2的
标准状况下 将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(S
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0 2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的B
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+C
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH="-574" kJ·mol-1②CH4(g)+4NO(g)=2N2(g)
下列反应中 盐酸既作还原剂 又表现出酸的性质的是A.B.C.D.
下列反应中,盐酸既作还原剂,又表现出酸的性质的是A.B.C.D.












