取2.5克KClO3粉末置于冰水冷却的锥形瓶中 加入5.0克研细的I2 再注入3cm3水 在45分钟
| 取2.5克KClO3粉末置于冰水冷却的锥形瓶中,加入5.0克研细的I2,再注入3cm3水,在45分钟内不断振荡,分批加入9~10cm3浓HCl,直到I2完全消失为止(整个反应过程保持在40℃以下)。将锥形瓶置于冰水中冷却,得到橙黄色的晶体A。 将少量A置于室温下的干燥的试管中,发现A有升华现象,用湿润的KI-淀粉试纸在管口检测,试纸变蓝.接着把试管置于热水浴中,有黄绿色的气体生成,管内的固体逐渐变成红棕色液体。 将少量A分别和KI,Na2S2O3,H2S等溶液反应,均首先生成I2。 酸性的KMnO4可将A氧化,得到的反应产物是无色的溶液。 (1)写出A的化学式;写出上述制备A的配平的化学方程式。 (2)写出A受热分解的化学方程式。 (3)写出A和KI反应的化学方程式。 附:原子量 K 39.10;Cl 35.45;I 126.9;O 16.00 |
参考解答
| (1)ICl3,KClO3十I2+6HCl=2ICl3+KCl+3H2O (2)ICl3=ICl+Cl2 (3)ICl3+3I-=2I2+3Cl |
| M(KClO3)=122.55g·mol-1,M(I2)=253.8g·mol-1 n(KClO3)=0.0204mol,n(I2)=0.0197mol,n(KClO3) 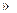 n(I2)。橙黄色的晶体A n(I2)。橙黄色的晶体A可以升华,A为分子晶体,A的化学式应为ICln。 生成A的反应物为:KClO3、I2、浓HCl,生成物为ICln和KCl。在ICln中I和Cl的氧化数分别为+n、-1。KClO3中Cl的氧化数降6,I2中I的氧化数升高n,根据氧化数的变化数相等,得:2n=6,n=3。A的化学式是ICl3。 (1)ICl3,KClO3十I2+6HCl=2ICl3+KCl+3H2O (2)ICl3=ICl+Cl2 (3)ICl3+3I-=2I2+3Cl |
相似问题
将NO3-+OH-+H2O+Zn→NH3+[Zn(OH)4]2-配平后 离子方程式中H2O的系数(化
将NO3-+OH-+H2O+Zn→NH3+[Zn(OH)4]2-配平后,离子方程式中H2O的系数(化学计量数)是[ ]A.2 B.4 C.6 D.8
矿物胆矾就是CuSO4·5H2O 当它溶于水渗入地下 遇到黄铁矿(FeS2) 铜将以辉铜矿(Cu2S
矿物胆矾就是CuSO4·5H2O,当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积下来;而反应得到的铁和硫则进入水溶液,该溶液无臭
(1)在一定条件下可以进行如下反应:H2O +R2O8n-+Mn2+→MnO4-+RO42-+ H+
(1)在一定条件下可以进行如下反应:H2O +R2O8n-+Mn2+→MnO4-+RO42-+ H+ (未配平),又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n
某溶液中Cl- Br- I-个数比为1∶2∶3 欲使这些离子个数比为3∶2∶1 那么要通入Cl2分子
某溶液中Cl-、Br-、I-个数比为1∶2∶3,欲使这些离子个数比为3∶2∶1,那么要通入Cl2分子个数与原溶液中I-个数比应为()A.1∶2B.2∶1C.1∶3D.3∶1
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法 过程如下:己知转化过程中反
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq) Cr2O72﹣(aq)+H2O(1)。转化












