还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法 过程如下:己知转化过程中反
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下: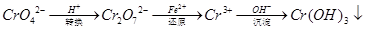 己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是 Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
|
参考解答
| B |
试题分析:A.CrO42﹣为黄色的,Cr2O72﹣为橙色的,如果2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)未达到平衡,正向进行,则橙色加深,如果逆向进行则黄色加深。现在溶液颜色保持不变,说明上述可逆反应达到达平衡状态。正确。B. 在1L废水中+6价的Cr的物质的量为n(Cr)=' 28.6g÷' 52g/mol ='0.55mol' .根据氧化还原反应中电子得失数目相等可得。n(FeSO4·7H2O)=3×0.55mol=1.65mol。m(FeSO4·7H2O) = 1.65mol×278g/mol=458.7g.错误。守恒可得0.55mol C. 2CrO42﹣(aq)+2H+(aq) Cr2O72﹣(aq)+H2O(1)未达到平衡,正向进行,则橙色加深,如果逆向进行则黄色加深。现在溶液颜色保持不变,说明上述可逆反应达到达平衡状态。正确。B. 在1L废水中+6价的Cr的物质的量为n(Cr)=' 28.6g÷' 52g/mol ='0.55mol' .根据氧化还原反应中电子得失数目相等可得。n(FeSO4·7H2O)=3×0.55mol=1.65mol。m(FeSO4·7H2O) = 1.65mol×278g/mol=458.7g.错误。守恒可得0.55mol C. 2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)的平衡常数为 Cr2O72﹣(aq)+H2O(1)的平衡常数为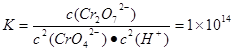 c(CrO42-)='{(28.6÷52)÷11mol/L=0.05mol/L,' c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,代入该平衡常数表达式中可得c(H+)=10-6mol/L.所以pH=6.正确。D. c(Cr3+)·c3(OH-)=1×10﹣32. c3(OH-)=1×10﹣32÷1×10﹣5=1×10﹣27.所以c(OH-)=1×10﹣9.c(H+)=1×10﹣14÷1×10﹣9=1×10﹣5. pH=5.正确. c(CrO42-)='{(28.6÷52)÷11mol/L=0.05mol/L,' c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,代入该平衡常数表达式中可得c(H+)=10-6mol/L.所以pH=6.正确。D. c(Cr3+)·c3(OH-)=1×10﹣32. c3(OH-)=1×10﹣32÷1×10﹣5=1×10﹣27.所以c(OH-)=1×10﹣9.c(H+)=1×10﹣14÷1×10﹣9=1×10﹣5. pH=5.正确. |
相似问题
(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目(2)2.8gCO的物质的量为
(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目(2)2 8gCO的物质的量为mol,含有个原子,完全与氧化铜反应时失去电子mol。
下列氧化还原反应中 1molH2O得到1mol电子的是 A.2F2+2H2O=4HF+O2B.2
下列氧化还原反应中,1molH2O得到1mol电子的是A.2F2+2H2O=4HF+O2B.2Na2O2+2H2O=4NaOH+O2↑C.2Na+2H2O=2NaOH+H2↑D.3NO2+H2O=2HNO3+NO
(1)配平下列离子反应方程式:______Cu2S+______HNO3--______Cu(NO3
(1)配平下列离子反应方程式:______Cu2S+______HNO3--______Cu(NO3)2+______H2SO4+______NO+______H2O(2)在标准状况下生成2 24LNO时,转移电子物质的量为______.
Na2C2O4能被高锰酸钾氧化生成二氧化碳。实验测知每生成1120mL(标准状况)二氧化碳需消耗10
Na2C2O4能被高锰酸钾氧化生成二氧化碳。实验测知每生成1120mL(标准状况)二氧化碳需消耗100mL0 1mol/L的高锰酸钾溶液,则反应后锰元素的化合价为A.+6B
配平氧化还原反应方程式。 (1)____ NH3+ _____NO2==_____N2+ _____
配平氧化还原反应方程式。 (1)____ NH3+ _____NO2==_____N2+ _____H2O (2) 氧化产物与还原产物的质量比为____________ 。












