(1)在一定条件下可以进行如下反应:H2O +R2O8n-+Mn2+→MnO4-+RO42-+ H+
| (1)在一定条件下可以进行如下反应:H2O +R2O8n-+Mn2+→MnO4-+RO42-+ H+ (未配平),又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n的值为 。 (2)反应 2KMnO4 + 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O 可用于实验室制取氯气 ①用双线桥表示出该反应的电子转移情况: 2KMnO4 + 16HCl =" 2KCl" + 2MnCl2+ 5Cl2↑+ 8H2O ②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂 mol,被氧化的物质的质量为 g。 |
参考解答
| (1) 2 。 (2)① 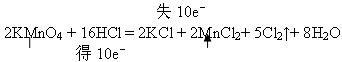 ② 0.04 mol, 7.3 g。 |
| 略 |
相似问题
某溶液中Cl- Br- I-个数比为1∶2∶3 欲使这些离子个数比为3∶2∶1 那么要通入Cl2分子
某溶液中Cl-、Br-、I-个数比为1∶2∶3,欲使这些离子个数比为3∶2∶1,那么要通入Cl2分子个数与原溶液中I-个数比应为()A.1∶2B.2∶1C.1∶3D.3∶1
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法 过程如下:己知转化过程中反
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq) Cr2O72﹣(aq)+H2O(1)。转化
(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目(2)2.8gCO的物质的量为
(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目(2)2 8gCO的物质的量为mol,含有个原子,完全与氧化铜反应时失去电子mol。
下列氧化还原反应中 1molH2O得到1mol电子的是 A.2F2+2H2O=4HF+O2B.2
下列氧化还原反应中,1molH2O得到1mol电子的是A.2F2+2H2O=4HF+O2B.2Na2O2+2H2O=4NaOH+O2↑C.2Na+2H2O=2NaOH+H2↑D.3NO2+H2O=2HNO3+NO
(1)配平下列离子反应方程式:______Cu2S+______HNO3--______Cu(NO3
(1)配平下列离子反应方程式:______Cu2S+______HNO3--______Cu(NO3)2+______H2SO4+______NO+______H2O(2)在标准状况下生成2 24LNO时,转移电子物质的量为______.












