A D E M L是原子序数依次增大的五种短周期元素.已知A是元素周期表中原子半径最小的元素;D的某
| A、D、E、M、L是原子序数依次增大的五种短周期元素.已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物.回答下列问题: (1)元素D在元素周期表中的位置是______. (2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为______. (3)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为______.(填化学式) (4)设化合物甲、乙、丙分别为DA3EA、DA3EDA3、A2E. ⅰ:已知:(1)丙(g)═丙(l)△H=-Q1 kJ?mol-1 (2)2甲(l)+3E2(g)═2DE2(g)+4丙(g)△H=-Q2 kJ?mol-1 Q1、Q2均大于0.若要使32g液态甲完全燃烧并恢复到室温,放出的热量为______. ⅱ:已知:2甲(g)=乙(g)+丙(g).在某温度下,在1L密闭容器中加入甲,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
②10min内平均反应速率v(甲)=______. ⅲ:如图是乙为燃料的绿色电源工作原理示意图.若b电极的反应式为:3O2+12e-+12H+═6H2O,则a电极的反应式为:______. 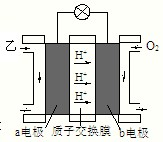 |
参考解答
| A是元素周期表中原子半径最小的元素,应为H元素;D的某种单质是天然存在的最硬物质,应为C元素;E是地壳中含量最多的元素,应为O元素;M与A位于同一主族,且原子序数大于O,应为Na元素;L与M能够形成ML型离子化合物,且L的原子序数最大,应为Cl元素,则 (1)D为C元素,原子序数为6,原子核外有2个电子层,最外层电子为4,应位于周期表第二周期第IVA族, 故答案为:第二周期第IVA族; (2)L的单质为Cl2,M为Na元素,对应的最高价氧化物为NaOH,二者反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O, 故答案为:Cl2+2OH-=ClO-+Cl-+H2O; (3)物质的量浓度相同的MEA、MADE3、MLE三种溶液分别为NaOH、NaHCO3、NaClO,NaOH为强碱,抑制水的电离, NaHCO3、NaClO为强碱弱酸盐,发生水解,促进水的电离,由于碳酸的酸性比HClO强,则NaClO水解程度较大,水的电离程度较大, 则有水的电离程度由大到小的顺序为NaClO>NaHCO3>NaOH, 故答案为:NaClO>NaHCO3>NaOH; (4)ⅰ:甲、乙、丙分别为CH3OH、CH3OCH3、H2O,则 (1)H2O(g)═H2O(l)△H=-Q1 kJ?mol-1 (2)2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-Q2 kJ?mol-1, 利用盖斯定律将(1)×4+(2)可得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-(4Q1+Q2)kJ?mol-1, 32g液态CH3OH的物质的量为n(CH3OH)=
所以1molCH3OH完全燃烧并恢复到室温,放出的热量为0.5mol×(4Q1+Q2)kJ?mol-1=(2 Q1+0.5 Q2)kJ, 故答案为:(2 Q1+0.5 Q2)kJ; ⅱ:①已知:2CH3OH(g)=CH3OCH3(g)+H2O(g), 则k=
②v(CH3OH)=2v(CH3OCH3)=2×
ⅲ:b电极为原电池的正极,a为原电池的负极,(CH3)2O被氧化生成二氧化碳,电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+, 故答案为:(CH3)2O-12e-+3H2O=2CO2+12H+. |
相似问题
有A B C D E 5种元素 它们的核电荷数依次增大 且都小于20.其中C E是金属元素;A和E属
有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,它
短周期元素 A B C D 原子序数依次增大 且只有 C 为金属元素. A C 位于同一主族 B 的
短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素.A、C位于同一主族,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子
X Y Z均为短周期元素 Z的原子序数等于X Y的原子序数之和 Z的原子最外层电子数为奇数 且Z的阴
X、Y、Z均为短周期元素,Z的原子序数等于X、Y的原子序数之和,Z的原子最外层电子数为奇数,且Z的阴离子比X的阳离子多三个电子层,下列推断中不正确的是(
(2七11?下城区模拟)原子序数由小到大排列的2种短周期主族元素X Y Z W 其中Z W两原子的核
(2七11?下城区模拟)原子序数由小到大排列的2种短周期主族元素X、Y、Z、W,其中Z、W两原子的核外电子数之和为X、Y两原子核外电子电子数之和的三倍,Y、Z
同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟
同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟化物的熔点见下表.氟化物AFBF2DF4熔点 K12661












