同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟
同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟化物的熔点见下表.
(2)元素C的最高价氧化物对应水化物的电离方程式为______; (3)解释上表中氟化物熔点差异的原因:______; (4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是______(填化学式).A、B、C三种原子形成的简单离子的半径由大到小的顺序为______(填离子符号). 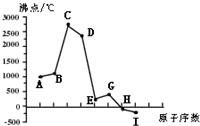 |
参考解答
| 图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,H、I的沸点低于0℃,根据气体的沸点都低于0℃,可推断H、I为气体,气体元素单质为非气体,故为第三周期元素,则A为Na,B为Mg,C为Al,D为Si,E为P、G为S,H为Cl,I为Ar, (1)A为Na元素,原子核外电子数为11,故共有11种不同运动状态的电子,原子核外电子排布式为1s22s22p63s1,有4种不同能级的电子, 故答案为:11;4; (2)氢氧化铝为两性氢氧化物,电离方程式为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-, 故答案为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-; (3)NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,故MgF2的熔点比NaF高, 故答案为:NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,故MgF2的熔点比NaF高; (4)同周期自左而右非金属性增强,非金属性Cl>S>P,非金属性越强氢化物越稳定,故HCl最稳定性, Na+、Mg2+、Al3+电子层结构相同,电子层结构相同核电荷数越大离子半径越小,故离子半径Na+>Mg2+>Al3+, 故答案为:HCl;Na+>Mg2+>Al3+. |
相似问题
下列关于原子结构 元素性质的说法正确的是( )A.非金属元素组成的化合物中只含共价键B.U-235
下列关于原子结构、元素性质的说法正确的是( )A.非金属元素组成的化合物中只含共价键B.U-235与U-238是中子数不同质子数相同的同种核素C.ⅦA族元
A B C D E五种短周期元素 原子序数E>D>A>B>C 且A B D E同周期 A C同主族
A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的
有关元素X Y Z W的信息如下:元素有关信息X原子半径为0.074nm 其氢化物的结构模型可表示为
有关元素X、Y、Z、W的信息如下:元素有关信息X原子半径为0 074nm,其氢化物的结构模型可表示为:常温下是液体Y原子半径为0 102nm,其原子核外电子排布为
X Y Z W是原子序数依次增大的四种短周期元素.X与W可形成正四面体型的共价化合物 Y的次外层电子
X、Y、Z、W是原子序数依次增大的四种短周期元素.X与W可形成正四面体型的共价化合物,Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y、Z的最外
在人体所需的十多种微量元素中 有一种称为“生命元素”的R元素 对延长人类寿命起着重要的作用.已知R元
在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素,对延长人类寿命起着重要的作用.已知R元素的原子有四个电子层,其最高价氧化物分子式为R












