有A B C D E 5种元素 它们的核电荷数依次增大 且都小于20.其中C E是金属元素;A和E属
| 有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,它们原子最外层的P轨道电子数是s轨道电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题: (1)A是______,B是______,C是______,D是______,E是______.(用元素符号表示) (2)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)______. (3)元素B与D的电负性的大小关系是______,C与E的第一电离能的大小关系是______.(填>、<、﹦,用元素符号表示) (4)用轨道表示式表示D元素原子的外围电子构型______. (5)写出A和B按原子个数比1:1形成的化合物的电子式______. (6)用电子式表示D和E形成离子化合物的形成过程______. |
参考解答
| A、B、C、D、E 5种元素,它们的核电荷数依次增大,A和E属同一族,它们原子的最外层电子排布为ns1,应为第ⅠA族元素,E是金属元素,则A应为H元素,为非金属元素,B和D也属同一族,它们原子最外层的P轨道电子数是s轨道电子数的两倍,价层电子排布为ns2np4,应为第ⅥA族元素,则B为O元素,D为S元素,C原子最外层上电子数等于D原子最外层上电子数的一半,则最外层电子数为3,应为Al元素,则E应为K元素, (1)由以上分析可知A为H,B为O,C为Al,D为S,E为K,故答案为:H;O;Al;S;K; (2)Al3+核外有2个电子层,K+、S2-有3个电子层,电子层数越多,半径越大,核外电子排布相同的离子,核电荷数越大,半径越小,则离子半径大小顺序为Al3+<K+<S2-, 故答案为:Al3+<K+<S2-; (3)同主族元素从上到下元素的电负性逐渐减小,则电负性O>S,同主族元素从上到下元素的第一电离能逐渐减小,同周期从左到右元素的第一电离能逐渐增大,则第一电离能Al>K,故答案为:O>S;Al>K; (4)D为S,价层电子排布为3s23p4,用轨道表示式表示D元素原子的外围电子构型为 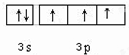 ,故答案为:  ; (5)A和B按原子个数比1:1形成的化合物为H2O2,为共价化合物,电子式为 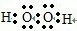 ,故答案为:  ; (6)D为S,E为K,电子式表示D和E形成离子化合物的形成过程为 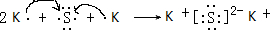 ,故答案为: 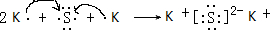 . |
相似问题
短周期元素 A B C D 原子序数依次增大 且只有 C 为金属元素. A C 位于同一主族 B 的
短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素.A、C位于同一主族,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子
X Y Z均为短周期元素 Z的原子序数等于X Y的原子序数之和 Z的原子最外层电子数为奇数 且Z的阴
X、Y、Z均为短周期元素,Z的原子序数等于X、Y的原子序数之和,Z的原子最外层电子数为奇数,且Z的阴离子比X的阳离子多三个电子层,下列推断中不正确的是(
(2七11?下城区模拟)原子序数由小到大排列的2种短周期主族元素X Y Z W 其中Z W两原子的核
(2七11?下城区模拟)原子序数由小到大排列的2种短周期主族元素X、Y、Z、W,其中Z、W两原子的核外电子数之和为X、Y两原子核外电子电子数之和的三倍,Y、Z
同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟
同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟化物的熔点见下表.氟化物AFBF2DF4熔点 K12661
下列关于原子结构 元素性质的说法正确的是( )A.非金属元素组成的化合物中只含共价键B.U-235
下列关于原子结构、元素性质的说法正确的是( )A.非金属元素组成的化合物中只含共价键B.U-235与U-238是中子数不同质子数相同的同种核素C.ⅦA族元












