W X Y Z是四种常见的短周期元素 其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为1
| W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是 是同周期中非金属性最强的元素. (1)X位于元素周期表的位置______,X与硫元素形成的化合物的电子式为______ (2)Z的气态氢化物和溴化氢相比,较稳定的是______ (写化学式).理由为______. (3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中有存在的作用力有______ 其分子属于______(填极性分子、非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是______. (4)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是______. 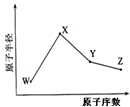 |
参考解答
| W的一种核素的质量数为18,中子数为10,则W的质子数目为8,所以W为O,W、X、Y、Z四种常见的短周期元素的原子半径随原子序数的递增逐渐减小,所以X和Ne原子的核外电子数相差1时,只能为Na,Y的单质是一种常见的半导体材料,即为Si,Z是同周期中非金属性最强的元素,半径最小,所以为Cl. (1)钠位于元素周期表的位置:第三周期、第IA族,硫化钠是离子化合物,电子式为: 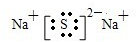 ,故答案为:第三周期、第IA族; 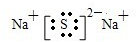 ; (2)原子的得电子能力越强则元素的非金属性越强,氢化物越稳定,得电子能力:Cl>Br,所以气态氢化物较稳定的是HCl,故答案为:HCl;氯元素的非金属性强于溴元素,所以HCl比HBr稳定; (3)SiCl4属于极性键构成的非极性分子,属于分子晶体,晶体中有存在的作用力有范德华力(或分子间作用力)极性共价键(或共价键);它和足量水反应,有白色胶状沉淀硅酸产生,故答案为:范德华力(或分子间作用力)极性共价键(或共价键);非极性分子;SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl; (4)反应SiH4+2O2=SiO2+2H2O转移的电子数目相等为8mol,每转移1mol电子放热190.0kJ,所以SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol, 故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol. |
相似问题
A D E M L是原子序数依次增大的五种短周期元素.已知A是元素周期表中原子半径最小的元素;D的某
A、D、E、M、L是原子序数依次增大的五种短周期元素.已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元
有A B C D E 5种元素 它们的核电荷数依次增大 且都小于20.其中C E是金属元素;A和E属
有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,它
短周期元素 A B C D 原子序数依次增大 且只有 C 为金属元素. A C 位于同一主族 B 的
短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素.A、C位于同一主族,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子
X Y Z均为短周期元素 Z的原子序数等于X Y的原子序数之和 Z的原子最外层电子数为奇数 且Z的阴
X、Y、Z均为短周期元素,Z的原子序数等于X、Y的原子序数之和,Z的原子最外层电子数为奇数,且Z的阴离子比X的阳离子多三个电子层,下列推断中不正确的是(
(2七11?下城区模拟)原子序数由小到大排列的2种短周期主族元素X Y Z W 其中Z W两原子的核
(2七11?下城区模拟)原子序数由小到大排列的2种短周期主族元素X、Y、Z、W,其中Z、W两原子的核外电子数之和为X、Y两原子核外电子电子数之和的三倍,Y、Z












