(15分)【化学—选修3:物质结构与性质】 a b c d f五种前四周期元素 原子序数依次增大;a
| (15分)【化学—选修3:物质结构与性质】 a、b、c、d、f五种前四周期元素,原子序数依次增大;a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b),且其中基态b原子的2p轨道处于半充满状态; d为周期表前四周期中电负性最小的元素;f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号) (1)写出ac2的电子式__________;基态f原子的外围电子排布式为 。 (2)写出一种与ac2互为等电子体的物质的化学式 。 (3)b的简单氢化物的沸点比同族元素氢化物的沸点 。(填“高”或“低”) 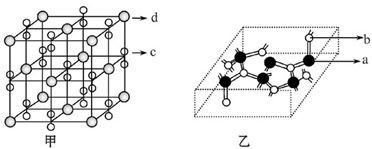 (4)化合物M由c、d两种元素组成,其晶胞结构如甲,则M的化学式为 。 (5)化合物N的部分结构如乙,N由a、b两元素组成,则硬度超过金刚石。试回答:①N的晶体类型为________________________,其硬度超过金刚石的原因是___________________。 ②N晶体中a、b两元素原子的杂化方式均为___________________。 |
参考解答
| (除标注外,每空2分,共15分) (1) 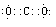 3d104s1 3d104s1 (2) N2O(写NO2+也计分) (3) 高 (4) KO2 (5) ① 原子晶体 (1分) C—N键的键长小于C—C键,C—N键的键能大于C—C键 (合理答案均计分) ②SP3 |
试题分析:a、b、c三种元素的基态原子具有相同的能层和能级,说明三种元素属于同周期元素,基态b原子的2p轨道处于半充满状态;所以b是N元素,第一电离能I1(a)<I1(c)<I1(b),则a、c分别是C、O元素;d为周期表前四周期中电负性最小的元素,则d是K元素;f的原子序数为29,f是Cu元素。 (1)二氧化碳的电子式为 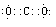 ;基态f原子的外围电子的排布式为3d104s1 ; ;基态f原子的外围电子的排布式为3d104s1 ;(2)CO2是3原子16价电子的分子,与之互为等电子体的物质有N2O; (3)N的氢化物是NH3,氨气分子间能形成氢键使沸点升高,所以b的简单氢化物的沸点比同族元素氢化物的沸点高; (4)根据“均摊法”,甲中d的个数为8×1/8+6×1/6=4,c2的个数是12×1/4+1=4,所以M的化学式为KO2 (5)①N的硬度超过金刚石,所以N是原子晶体;N原子的半径比C小,所以C-N的键长比C-C的键长短键能大,共价键强,硬度大。 ②N晶体中,C原子周围都是4个共价单键,所以是sp3杂化,N原子周围是3个根据单键,还有1对未成键电子,所以也是sp3杂化。 |
相似问题
下列各组顺序的排列不正确的是( )A.原子半径:Na>Mg>Al>HB.热稳定性: HC l<
下列各组顺序的排列不正确的是( )A.原子半径:Na>Mg>Al>HB.热稳定性: HC l<H2S<PH3C.酸性强弱:H2SiO3<H2CO3<H3PO4D.氧化性:K+<Na+<Mg2+<Al3+
根据元素周期表 填写下列空白:(1)最活泼的非金属元素位于周期表中第 周期第 族 第
根据元素周期表,填写下列空白:(1)最活泼的非金属元素位于周期表中第周期第族、第纵行。某元素B含有8个质子、10个中子,用表示B原子的组成,(2)在
(14分)下图是元素周期表的一部分① ② ③④
(14分)下图是元素周期表的一部分①②③④⑤⑥⑦⑧⑨⑩(1)元素⑨的价电子轨道表示式为,元素⑩的次外层电子数为个。(2)如果在温度接近373K时,根据M
元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a 次外层电子数为b;B元素原子的M层
元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形
(14分)现有5种短周期元素A B C D E 原子序数依次增大。A的同位素中有一种核素无中子 B最
(14分)现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物












