(14分)现有5种短周期元素A B C D E 原子序数依次增大。A的同位素中有一种核素无中子 B最
| (14分)现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题: (1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式 。 (2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为 ,1molCS2中含有的π键为 个。 (3)Y的中心原子的杂化轨道类型为 ,分子的立体构型为 。 (4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因 。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为 。 (5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为 ,该氮化钛的化学式为 ,氮原子的配位数为 。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为 g.cm3(NA为阿佛加德罗常数值,只列式计算)。 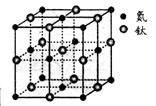 |
参考解答
| (1)Na+[:H-(1分) (2)S=C=S(1分),2×6.02×1023个(1分) (3)sp3(1分),三角锥形(1分) (4)HCO3-+H2O  H2CO3+OH-(2分) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(2分) H2CO3+OH-(2分) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(2分)(5)1S22S22p63S23d24S2(1分) TiN(1分) 6(1分)62×4/(2a×10-10)NA(2分) |
试题分析:现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,则A是氢元素;B最外层上电子数是次外层电子数的两倍,因此B是碳元素;C元素最简单的氢化物Y的水溶液呈碱性,则C是氮元素,Y是氨气。E是短周期中电负性最小的元素,则E的金属性最强,因此是钠元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物,这说明D是氧元素。 (1)A、E两元素形成的原子个数比为1:1的化合物是氢化钠,含有离子键,电子式为 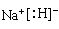 。 。(2)CS2和B、D元素形成的一种化合物为等电子体,该化合物是CO2,二氧化碳是直线形结构,因此则CS2的分子结构为直线形,结构式为S=C=S。双键是由1个δ键和 1个π键构成的,1molCS2分子中含有2个碳硫双键,因此含有的π键为2×6.02×1023个个。 (3)氨气分子中氮原子含有1对孤对电子,价层电子对数是4,速中心原子的杂化轨道类型为sp3,分子的立体构型为三角锥形。 (4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,则该化合物分别是碳酸钠和碳酸氢钠,二者均强碱弱酸盐,水解溶液显碱性,因此Z溶液显碱性的原因是HCO3-+H2O  H2CO3+OH-。由于碳酸氢根的水解程度大于电离程度,因此等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。 H2CO3+OH-。由于碳酸氢根的水解程度大于电离程度,因此等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。(5)钛是22号元素,依据核外电子排布规律可知钛原子的电子排布式为1S22S22p63S23d24S2。根据晶胞结构可知钛原子个数是1+12× 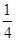 =4,氮原子个数是8× =4,氮原子个数是8×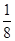 +6× +6×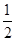 =4,因此化学式为TiN。氮原子周围离氮原子最近的钛原子个数6个(上下左右前后各1个),因此氮原子的配位数为6。晶胞中N、Ti之间的最近距离为apm,则晶胞的边长是2a×10-10 cm,则有 =4,因此化学式为TiN。氮原子周围离氮原子最近的钛原子个数6个(上下左右前后各1个),因此氮原子的配位数为6。晶胞中N、Ti之间的最近距离为apm,则晶胞的边长是2a×10-10 cm,则有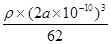 ×NA=4,即则氮化钛的密度为62×4/(2a×10-10)NAg.cm3。 ×NA=4,即则氮化钛的密度为62×4/(2a×10-10)NAg.cm3。 |
相似问题
(12分)A B C D E五种短周期元素 其原子序数依次增大 而原子半径按A C B E D顺序依
(12分)A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之
以下有关原予结构及元素周期律的叙述正确的是A.同主族元素从上到下 单质的熔点逐渐降低B.同周期元素(
以下有关原予结构及元素周期律的叙述正确的是A.同主族元素从上到下,单质的熔点逐渐降低B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小C.第
X元素的阳离子与Y的阴离子具有相同的核外电子排布 则下列比较中正确的是( ) A.原子序数:
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )A.原子序数: X<YB.原子半径:X<YC.离子半径:X>YD.原子最外层电子数:X<Y
下列各组性质的比较中正确的是( )A.酸性 HClO4<HBrO4<HIO4B.碱性 Ba(OH)2
下列各组性质的比较中正确的是()A.酸性 HClO4<HBrO4<HIO4B.碱性 Ba(OH)2>Ca(OH)2>Mg(OH)2C.稳定性 HCl>PH3>H2SD.还原性 Cl->Br->I-
短周期元素R T X Y Z在元素周期表的相对位置如下表所示 它们的最外层电子数之和为24。则下列判
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是()RTXYZA.X位于元素周期表中第三周期第V












