(12分)A B C D E五种短周期元素 其原子序数依次增大 而原子半径按A C B E D顺序依
| (12分)A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题: (1)E元素在周期表中的位置 ;化合物M中含有的化学键类型有 (2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示): ;写出C与A形成的18e-化合物的电子式 ; (3)用电子式表示A2C的形成过程: (4)写出题中生成M的化学方程式 |
参考解答
(1)第三周期第ⅣA族;离子键、(极性)共价键;(2)H2O>NH3>SiH4;H2O2的电子式: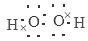 (3)H2O的形成过程: 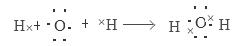 (4)NH3+HNO3=NH4NO3 (4)NH3+HNO3=NH4NO3 |
试题分析:根据题意可得:A是H,B是N;C是O;D是Na;E是Si。(1)Si元素核外电子排布是2、8、4,在周期表中的位置是位于第三周期第ⅣA族;化合物M是NH4NO3,是离子化合物。在阳离子和阴离子中都含有极性共价键,所以在该化合物中含有离子键和减小共价键。(2)元素的非金属性越强,其对应的氢化物的稳定性就越强,由于非金属性O>N>Si,所以O、N、Si形成的气态氢化物的稳定性由强到弱的顺序是H2O>NH3>SiH4;O与H形成的18e-化合物H2O2的电子式是 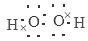 ;(3)H2O的形成过程电子式表示是: ;(3)H2O的形成过程电子式表示是: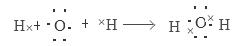 ;(4)生成M NH4NO3的化学方程式是NH3+HNO3=NH4NO3。 ;(4)生成M NH4NO3的化学方程式是NH3+HNO3=NH4NO3。 |
相似问题
以下有关原予结构及元素周期律的叙述正确的是A.同主族元素从上到下 单质的熔点逐渐降低B.同周期元素(
以下有关原予结构及元素周期律的叙述正确的是A.同主族元素从上到下,单质的熔点逐渐降低B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小C.第
X元素的阳离子与Y的阴离子具有相同的核外电子排布 则下列比较中正确的是( ) A.原子序数:
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )A.原子序数: X<YB.原子半径:X<YC.离子半径:X>YD.原子最外层电子数:X<Y
下列各组性质的比较中正确的是( )A.酸性 HClO4<HBrO4<HIO4B.碱性 Ba(OH)2
下列各组性质的比较中正确的是()A.酸性 HClO4<HBrO4<HIO4B.碱性 Ba(OH)2>Ca(OH)2>Mg(OH)2C.稳定性 HCl>PH3>H2SD.还原性 Cl->Br->I-
短周期元素R T X Y Z在元素周期表的相对位置如下表所示 它们的最外层电子数之和为24。则下列判
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是()RTXYZA.X位于元素周期表中第三周期第V
一容器中X元素构成的气态单质X2分子有3种 相对分子质量分别为32 34 36。又知容器中3种分子数
一容器中X元素构成的气态单质X2分子有3种,相对分子质量分别为32、34、36。又知容器中3种分子数之比为15∶4∶1。由此可以确定的是()A.若容器中X2全部












