(12分)【化学——物质结构与性质】物质的结构决定性质 性质反映其结构特点。(1)金刚石和石墨是碳元
| (12分)【化学——物质结构与性质】 物质的结构决定性质,性质反映其结构特点。 (1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有 a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化; b.晶体中共价键的键长:金刚石中C—C<石墨中C—C; c.晶体的熔点:金刚石< 石墨 d.晶体中共价键的键角:金刚石>石墨 (2)某石蕊的分子结构如图所示。 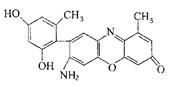 ①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是 (填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是 (填化学式); ②该石蕊易溶解于水,分析可能的原因是 ; (3)铜及其合金是人类最早使用的金属材料。 ①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 Cu NF3+3NH4F 上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。 a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体 ②金属铜采取如图所示堆积方式,可称为_____堆积,则Cu晶体中 Cu原子的配位数为 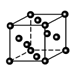 |
参考解答
| (1)a c(2分) (2)①C O (2分) H3O+(2分)②该石蕊分子中含有—OH和—NH2,均能与H2O形成氢键;由结构知,该分子为极性分子,根据相似相溶原理,易溶于水。(2分) (3) ① abd (2分) ②面心立方堆积(1分) 12 (1分) |
试题分析:(1)a.金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,碳原子的杂化类型为sp3杂化;石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构,碳原子的杂化类型为sp2杂化,正确;b.sp2杂化中,s轨道的成分比sp3杂化更多,而且石墨的碳原子还有大π键所以形成的共价键更短,更牢固,即石墨的层内共价键键长比金刚石的键长短,错误;c.石墨的层内共价键键长比金刚石的键长短,作用力更大,破坏化学键需要更大能量,所以晶体的熔点金刚石<石墨,正确;d.金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,键角为109°28′,石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,键角为120°,错误;选ac;(2)①石蕊分子所含元素中,基态碳原子和氧原子的核外电子排布式分别为1s22s22p2、1s22s22p4,,2p轨道有两个成单电子的是C、O; 由其中两种元素形成的三角锥构型的一价阳离子是H3O+;②该石蕊易溶解于水,可能的原因是该石蕊分子中含有—OH和—NH2,均能与H2O形成氢键;由结构知,该分子为极性分子,根据相似相溶原理,易溶于水;(3)①NF3、NH3和F2属于分子晶体,Cu属于金属晶体,NH4F属于离子晶体,选abd;②金属铜的堆积方式称为面心立方堆积,则Cu晶体中Cu原子的配位数为12。 |
相似问题
元素Y的原子获得3个电子或元素X的原子失去2个电子后 它们的电子层结构与氖原子的电子层结构相同 X
元素Y的原子获得3个电子或元素X的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确化学式
(9分)下图为周期表中的一部分。已知A B C D均为短周期元素 A与D原子序数之和为C原子序数的1
(9分)下图为周期表中的一部分。已知A、B、C、D均为短周期元素,A与D原子序数之和为C原子序数的1.5倍。(1)B元素符号是: _______、D在元素周期表中
四种主族元素的离子a Xm+ bYn+ cZn-和dRm-(a b c d为元素的原子序数) 它们具
四种主族元素的离子a Xm+,bYn+,cZn-和dRm-(a,b,c,d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )①a-
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半 该元素( ) A.在自然界中只
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )A.在自然界中只以化合态的形式存在B.单质常用作半导体材料和光导纤维C.最
(10分)下表为元素周期表中的一部分.用化学式或元素符号回答下列问题: IAⅡAⅢAⅣAVAⅥAⅦA
(10分)下表为元素周期表中的一部分.用化学式或元素符号回答下列问题:IAⅡAⅢAⅣAVAⅥAⅦA02⑥⑦3①③⑤⑧⑩4②④⑨(1)10种元素中,化学性质最不活












