实验室里迅速制备少量氯气可利用以下反应:______KMnO4+______ HCl═______
| 实验室里迅速制备少量氯气可利用以下反应: ______KMnO4+______ HCl═______ KCl+______ MnCl2+______ Cl2↑+______ H2O (1)请配平上述化学方程式,并在上面用“双线桥法”标明电子转移的方向和数目: (2)该反应的氧化产物是______,KMnO4发生______反应. (3)HCl在上述反应中显示出来的性质是______. A.氧化性 B.还原性 C.酸性 D.碱性 (4)用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为______mol,需要KMnO4的质量______g,转移电子数为______. |
参考解答
| (1)反应中HCl→Cl2,氯元素化合价由-1价升高为0价,共升高2价,KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为10,故KMnO4系数为2,故Cl2系数为5,根据Mn元素守恒可知MnCl2系数为2,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为16,根据H元素可知H2O的系数为8,配平后方程式为: 2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8 H2O,用“双线桥法”标明电子转移的方向和数目为: 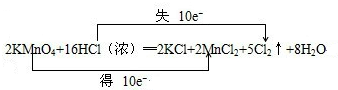 ; 故答案为:2、16、2、2、5、8;  (2)反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,Cl2是氧化产物; 反应KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,KMnO4是氧化剂,发生还原反应; 故答案为:Cl2;还原; (3)由方程式可知,反应后KCl、Cl2中含有氯元素,KCl中氯元素化合价为-1价,Cl2中氯元素化合价为0价,说明反应中HCl表现酸性、还原性; 故选BC; (4)560mlCl2的物质的量为
根据2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8 H2O可知,生成0.025molCl2,需要KMnO4的物质的量为:0.025mol×
反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,故转移电子物质的量为0.025mol×2=0.05mol,转移电子数目为0.05mol×NAmol-1=0.05NA; 故答案为:0.05;1.58;0.05NA. |
相似问题
0.96 g Mg跟含6.3gHNO3的稀溶液恰好反应完全 则HNO3还原产物的式量是:A.30B.
0 96 g Mg跟含6 3gHNO3的稀溶液恰好反应完全,则HNO3还原产物的式量是:A.30B.44C.46D.80
(1)金属锰可以用四氧化三锰为原料通过铝热法来制备。试写出配平的化学方程式。(2)CS2是一种有恶臭
(1)金属锰可以用四氧化三锰为原料通过铝热法来制备。试写出配平的化学方程式。(2)CS2是一种有恶臭的液体,把它滴入硫酸酸化的高锰酸钾水溶液,将析出
配平并完成方程式。(1) Pt+ HNO3+ HCl H2PtCl6+ NO↑+
配平并完成方程式。(1) Pt+ HNO3+ HCl H2PtCl6+ NO↑+ ( )(2)Fe+ HNO3(稀) Fe(NO3)3+ NO↑+ H2O被还原与未被还原的氮元素质量之比。(3
钛(Ti)具有高强度和耐酸腐蚀性 是重要的工业原料.以金红石(主要成分为TiO2 含少量Fe2O3
钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下:(1)粗TiCl4中含有
某短周期主族元素的原子最外层电子数为次外层的2倍 其单质甲可发生如下反应:甲+乙△丙+丁+水.(1)
某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙△丙+丁+水.(1)若丙为NO2.①甲与乙反应的化学方程式为______.②N












