钛(Ti)具有高强度和耐酸腐蚀性 是重要的工业原料.以金红石(主要成分为TiO2 含少量Fe2O3
钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下: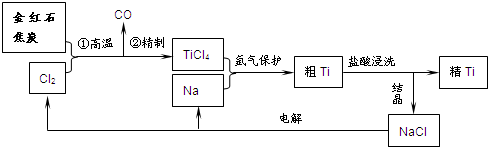 (1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
(2)写出金红石高温反应制取TiCl4的化学方程式______. (3)写出电解熔融NaCl的化学方程式______;阴极产物是______. (4)粗钛产品粉碎后要用盐酸浸洗.其主要目的是______. (5)Ti可溶解在浓HF溶液中,请完成下列离子方程式.______Ti+______HF-______TiF62-+______+______H2↑ |
参考解答
| (1)粗TiCl4中加热易气化,与固体混合物可用分馏的方法分离,由表中数据可知,TiCl4在水中强烈水解,易变质,且易溶于乙醚中,不能分离,只能用蒸馏的方法分离, 故答案为:B; (2)由流程图可知,反应为TiO2、C和Cl2,生成物为TiCl4和CO,则反应的化学方程式为TiO2+2C+2Cl2
故答案为:TiO2+2C+2Cl2
(3)电解氯化钠生成金属钠和氯气,方程式为2NaCl (熔融)
故答案为:2NaCl (熔融)
(4)粗钛产品中剩余的少量钠,加入盐酸和除去,并且Cl-浓度增大,有利于NaCl晶体析出, 故答案为:除去粗钛产品中剩余的少量钠,促进NaCl晶体析出(Cl-同离子效应); (5)反应前后Ti的化合价由0价升高为+4价,HF中H元素的化合价由+1价降低到0价,则有Ti~2H2, 则有1Ti+6HF=1TiF62-+2H++2H2↑, 故答案为:1;6;1;2;2. |
相似问题
某短周期主族元素的原子最外层电子数为次外层的2倍 其单质甲可发生如下反应:甲+乙△丙+丁+水.(1)
某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙△丙+丁+水.(1)若丙为NO2.①甲与乙反应的化学方程式为______.②N
已知下列物质在一定条件下氧化 KI时 自身发生如下变化:Fe3+→Fe2+ MnO-4→Mn2+ C
已知下列物质在一定条件下氧化 KI时,自身发生如下变化:Fe3+→Fe2+,MnO-4→Mn2+,Cl2→Cr-,HNO3→NO2。如果分别用等物质的量的下列这些物质与足量的K
菜温度下将氯气通入氢氧化钾溶液里 反应后得到KCI KClO KClO3的混合溶液。经测定ClO和C
菜温度下将氯气通入氢氧化钾溶液里,反应后得到KCI、KClO、KClO3的混合溶液。经测定ClO和ClO3的浓度之比为11:l,则氯气和氢氧化钾溶液反应时,被还原的氯
配平该化学方程式______K37ClO3+______H35Cl-______KCl+______
配平该化学方程式______K37ClO3+______H35Cl-______KCl+______Cl2+______H2O.该反应中HCl体现了______性,若反应中有1 5mol电子发生转移生成Cl2______mo
配平下列氧化还原反应方程式: K2S + HNO3 == KNO3 + NO↑+ S + H2O
配平下列氧化还原反应方程式:K2S + HNO3 ==KNO3 +NO↑+S +H2O当反应中有3mol电子发生转移时,有mol HNO3参加反应。












