某短周期主族元素的原子最外层电子数为次外层的2倍 其单质甲可发生如下反应:甲+乙△丙+丁+水.(1)
| 某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应: 甲+乙
(1)若丙为NO2. ①甲与乙反应的化学方程式为______. ②NO2可作火箭重要燃料-肼(N2H4)的助燃剂.已知: N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1, 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1. 写出燃料-肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:______. (2)若丙为SO2. ①把乙滴入硫酸铜晶体,观察到的现象是______. ②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:  MnO4-+  SO2+  ______=  Mn2++  SO42-+  H+ ③SO2在一定条件下,发生:2SO2(g)+O2(g)?2SO3(g)△H<0反应. 该反应的化学平衡常数K=______(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是______(填序号). a.x表示温度,y表示SO2的物质的量 b.x表示压强,y表示SO2的转化率 c.x表示SO2的物质的量,y表示O2的物质的量 d.x表示SO3的物质的量,y表示化学平衡常数K. 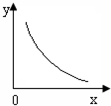 |
参考解答
短周期主族元素的原子最外层电子数为次外层的2倍,该原子有2个电子层,最外层电子数为4,为C元素,其单质甲为C单质,可以发生:甲+乙
(1)若丙为NO2,由转化关系可知,乙为HNO3,丁为CO2; ①碳与浓硝酸反应生成二氧化碳、二氧化氮、水,反应方程式为:C+4HNO3(浓)
故答案为:C+4HNO3(浓)
②已知:Ⅰ、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1, Ⅱ、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1. 根据盖斯定律,Ⅰ+Ⅱ得2N2H4(g)+2O2(g)=2N2(g)+4H2O(g)△H=-1068kJ?mol-1; 即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1; 故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1; (2)若丙为SO2,由转化关系可知,乙为H2SO4,丁为CO2; ①把硫酸滴入硫酸铜晶体中,浓硫酸具有吸水性,蓝色晶体变白色; 故答案为:蓝色晶体变白色; ②反应中MnO4-→Mn2+,Mn元素化合价由+7降低为+2,总共降低5价,SO2→SO42-,S元素化合价由+4升高为+6,总共升高2价,化合价升降最小公倍数为10,故MnO4-系数为2,故SO2系数为5,根据元素守恒故Mn2+系数为2,故SO42-系数为5,由电荷守恒故H+系数为4,根据元素守恒可知缺项为H2O,故H2O系数为2,配平后为:②2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+; 故答案为:2、5、2H2O、2、5、4; ③平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故可逆反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=
由图象可知,随x的增大y值降低, a.该反应为放热反应,升高温度平衡向逆反应反应,SO2的物质的量增大,图象与实际不相符,故a错误; b.反应为气体物质的量减小的反应,增大压强平衡向正反应移动,SO2的转化率增大,图象与实际不相符,故b错误; c.增大SO2的物质的量,平衡向正反应移动,O2的物质的量减小,图象与实际相符合,故c正确; d.化学平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变,图象与实际不相符,故d错误; 故答案为:
|
相似问题
已知下列物质在一定条件下氧化 KI时 自身发生如下变化:Fe3+→Fe2+ MnO-4→Mn2+ C
已知下列物质在一定条件下氧化 KI时,自身发生如下变化:Fe3+→Fe2+,MnO-4→Mn2+,Cl2→Cr-,HNO3→NO2。如果分别用等物质的量的下列这些物质与足量的K
菜温度下将氯气通入氢氧化钾溶液里 反应后得到KCI KClO KClO3的混合溶液。经测定ClO和C
菜温度下将氯气通入氢氧化钾溶液里,反应后得到KCI、KClO、KClO3的混合溶液。经测定ClO和ClO3的浓度之比为11:l,则氯气和氢氧化钾溶液反应时,被还原的氯
配平该化学方程式______K37ClO3+______H35Cl-______KCl+______
配平该化学方程式______K37ClO3+______H35Cl-______KCl+______Cl2+______H2O.该反应中HCl体现了______性,若反应中有1 5mol电子发生转移生成Cl2______mo
配平下列氧化还原反应方程式: K2S + HNO3 == KNO3 + NO↑+ S + H2O
配平下列氧化还原反应方程式:K2S + HNO3 ==KNO3 +NO↑+S +H2O当反应中有3mol电子发生转移时,有mol HNO3参加反应。
在一定条件下 RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。
在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是 [ ]A.+4B.+5C.+6D.+7












