Ⅰ.铬位于第四周期ⅥB族 主要化合价+2 +3 +6 单质硬度大 耐腐蚀 是重要的合金材料。(1)
| Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3 ,+6,单质硬度大,耐腐蚀,是重要的合金材料。 (1)基态铬原子的价电子排布图___________,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。 (2)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种浅绿色固体与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,则这种浅绿色固体中阳离子的化学式____________。 Ⅱ.砷化镓为第三代半导体材料,晶胞结构如图所示, 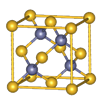 (3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式 为 。 (4)AsH3空间构型为 。 已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式是_______。 (5)砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g/mol,阿伏伽德罗常数值为NA,则砷化镓晶体密度的表达式_________ g/cm3。 |
参考解答
Ⅰ.(1)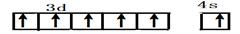 非极性 (2) [ Cr(H2O)5 Cl 2+ 非极性 (2) [ Cr(H2O)5 Cl 2+ Ⅱ.(3)CH3)3Ga+AsH3 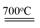 3CH4+GaAs (4)三角锥形 sp2 (5) 3 3CH4+GaAs (4)三角锥形 sp2 (5) 3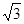 · b/16a3NA · b/16a3NA |
试题分析:Ⅰ.(1)铬是24号元素,其基态的价电子排布式是3d54S1,因此基态铬原子的价电子排布图 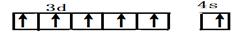 。因为CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶。根据相似相容原理,可判断出CrO2Cl2是非极性分子。(2) 浅绿色固体CrCl3·6H2O与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,说明三个Cl-中只有一个作配位体,由于其配位数为6,所以还有5个水作配位体。则这种浅绿色固体中阳离子的化学式[ Cr(H2O)5 Cl 2+。Ⅱ.(3)由题意得方程式:CH3)3Ga+AsH3 。因为CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶。根据相似相容原理,可判断出CrO2Cl2是非极性分子。(2) 浅绿色固体CrCl3·6H2O与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,说明三个Cl-中只有一个作配位体,由于其配位数为6,所以还有5个水作配位体。则这种浅绿色固体中阳离子的化学式[ Cr(H2O)5 Cl 2+。Ⅱ.(3)由题意得方程式:CH3)3Ga+AsH3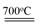 3CH4+GaAs。(4)同族元素形成的化合物结构相似。NH3为三角锥形,所以AsH3空间构型为三角锥形。因为(CH3)3Ga为非极性分子,说明这几个化学键是对称的。故其中镓原子的杂化方式是sp2杂化。(5)在砷化镓晶胞中,含有Ga:8×1/8+6×1/2=4,含有As:4个,因此每个晶胞中含有4和GaAs。在砷化镓晶体中最近的砷和镓原子核间距为a cm,由于As处于与它相连的四个Ga构成的四面体的几何中心。距离最近且相等的As原子之间的距离为L.则 3CH4+GaAs。(4)同族元素形成的化合物结构相似。NH3为三角锥形,所以AsH3空间构型为三角锥形。因为(CH3)3Ga为非极性分子,说明这几个化学键是对称的。故其中镓原子的杂化方式是sp2杂化。(5)在砷化镓晶胞中,含有Ga:8×1/8+6×1/2=4,含有As:4个,因此每个晶胞中含有4和GaAs。在砷化镓晶体中最近的砷和镓原子核间距为a cm,由于As处于与它相连的四个Ga构成的四面体的几何中心。距离最近且相等的As原子之间的距离为L.则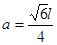 ; ;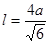 .最近的两个As在晶胞面对角线的1/2处。设该晶胞的长度是x,则 .最近的两个As在晶胞面对角线的1/2处。设该晶胞的长度是x,则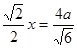 ;解得x= ;解得x=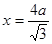 是则砷化镓晶体密度的表达式为: 是则砷化镓晶体密度的表达式为: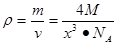 .整理可得 .整理可得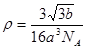 。 。 |
相似问题
下列说法正确的是A.Na Fe分别与不足量的稀硫酸反应所得溶液均呈中性B.将Ba(OH)2溶液滴到明
下列说法正确的是A.Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性B.将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以Al(OH)3的形式存在C.氢
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体 它能被“印”或“涂”在柔软塑料上 制成多种
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备。请回答下列问题:(1)O、S、Se
原子序数小于36的X Y Z W四种元素 元素X的原子核外最外层电子数是内层电子数的2倍 元素Y与X
原子序数小于36的X、Y、Z、W四种元素,元素X的原子核外最外层电子数是内层电子数的2倍,元素Y与X同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相
下列描述中正确的是A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中的空间构
下列描述中正确的是A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中的空间构型为正四面体形D.SiF4和SO32-的中心原子均为sp3杂化
(一)BaCl2·xH2O中结晶水数目可通过重量法来确定:①称取1.222g样品 置于小烧杯中 加入
(一)BaCl2·xH2O中结晶水数目可通过重量法来确定:①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置












