原子序数小于36的X Y Z W四种元素 元素X的原子核外最外层电子数是内层电子数的2倍 元素Y与X
| 原子序数小于36的X、Y、Z、W四种元素,元素X的原子核外最外层电子数是内层电子数的2倍,元素Y与X同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,Z是X的同族相邻元素;W是第Ⅷ族元素中原子序数最小的元素。用元素符号回答下列问题: (1)X、Y、Z的电负性由小到大的顺序是 。 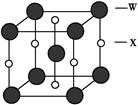 (2) 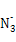 与X、Y形成的一种化合物互为等电子体,则 与X、Y形成的一种化合物互为等电子体,则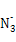 的空间构型为 、电子式为 。 的空间构型为 、电子式为 。 (3)同为原子晶体的ZX与ZY2中硬度小的是 。 (4)X和W所形成的某种晶体结构如图所示,写出: ①基态W2+的价电子排布式 ; ②该晶体的化学式 。 |
参考解答
| (1)Si<C<O(2分) (2)直线形(2分)  -(3分) -(3分)(3)SiO2(3分) (4)①3d6(2分) ②FeC(3分) |
| 根据元素的结构及有关性质可知,X、Y、Z、W四种元素分别是C、O、Si、Fe。 (1)非金属性越强,电负性越大,所以X、Y、Z的电负性由小到大的顺序是Si<C<O。 (2)价电子数和原子数分别都相等的是等电子体,所以与 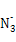 互为等电子体的是CO2,因此和CO2类似,N 互为等电子体的是CO2,因此和CO2类似,N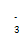 的空间构型为直线形,仿照 的空间构型为直线形,仿照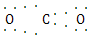 可得电子式为 可得电子式为 -。 -。(3)形成原子晶体的原子半径越小,共价键越强,硬度越大。碳原子半径小于硅原子半径,所以二氧化硅的硬度小。 (4)①根据构造原理可知,基态W2+的价电子排布式为3d6。 ②根据晶胞结构可知,含有铁原子是1+8×  =2,碳原子是2× =2,碳原子是2× +4× +4× =2,所以化学式是FeC。 =2,所以化学式是FeC。 |
相似问题
下列描述中正确的是A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中的空间构
下列描述中正确的是A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中的空间构型为正四面体形D.SiF4和SO32-的中心原子均为sp3杂化
(一)BaCl2·xH2O中结晶水数目可通过重量法来确定:①称取1.222g样品 置于小烧杯中 加入
(一)BaCl2·xH2O中结晶水数目可通过重量法来确定:①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置
依据物质的相关数据 可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是A.依据
依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是A.依据元素的原子序数,推断该元素原子的核外电子数B
卤素化学丰富多彩 能形成卤化物 卤素互化物 多卤化物等多种类型的化合物。(1)卤素互化物如IBr I
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。(1)卤素互化物如IBr ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸
已知A B C D E都是周期表中前四周期的元素 它们的核电荷数A<B<C<D<E。其中A B C是
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离












