卤素化学丰富多彩 能形成卤化物 卤素互化物 多卤化物等多种类型的化合物。(1)卤素互化物如IBr I
| 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。 (1)卤素互化物如IBr ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为 _____,I和Cl相比,电负性较大的是_____。 (2)基态溴原子的电子排布式为_____,碘原子价电子的电子排布图为_____。 (3)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______,中心I原子的杂化轨道类型为 __________。 (4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。 (5) 离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm( pm=10-12m), RbICl2晶胞中含有______个氯原子,RbICl2晶体的密度是_____g?cm3(只要求列箅式,不必计算出数值。阿伏伽德罗常数为NA)。 |
参考解答
| (15分 )(1)IBr>ICl>Cl2(2分)Cl(1分) (2)[Ar3d104s24p5(2分) 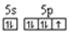 (2分)(3)V形(1分) sp3(1分) (2分)(3)V形(1分) sp3(1分)(4)①②③(2分)(5) 8(2分) 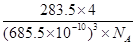 (2分) (2分) |
试题分析:(1)卤素单质形成的晶体均是分子晶体,分子间作用力越大,沸点越高。则Cl2、IBr、ICl沸点由髙到低的顺序为IBr>ICl>Cl2;非金属性越强,电负性越大,则I和Cl相比,电负性较大的是Cl。 (2)溴元素的原子序数是35,所以根据构造原理和能量最低原理可知,基态溴原子的电子排布式为[Ar3d104s24p5;I的原子序数是53,则碘原子价电子的电子排布图为 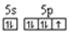 。 。(3)因为I3+可看成II2+,所以根据价层电子对互斥理论可知,I3+中中心原子含有的孤对电子对数=(7-1-2×1)÷2=2,所以其空间构型为V形,其中I原子的杂化轨道类型是sp3杂化。 (4)由于非金属性Cl>Br>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强。在②③中都是碘元素的含氧酸,非羟基氧个数越多,酸性越强,则酸性为②>③,故三种物质的酸性由强到弱的顺序为①②③。 (5)离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,所以晶体中阴离子数目为8× 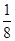 +6× +6×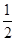 =4个,则根据该化合物的化学式可知,含有的氯原子数目是4×2=8个。根据 =4个,则根据该化合物的化学式可知,含有的氯原子数目是4×2=8个。根据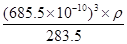 ×NA=4,解得ρ= ×NA=4,解得ρ=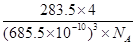 。 。 |
相似问题
已知A B C D E都是周期表中前四周期的元素 它们的核电荷数A<B<C<D<E。其中A B C是
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离
芦笋中的天冬酰胺(结构如图)和微量元素硒 铬 锰等 具有提高身体免疫力的功效。(1)天冬酰胺所含元素
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。(1)天冬酰胺所含元素中,_______(填元素名称)元素基态原子核外未成
亚氨基锂(Li2NH)是一种储氢容量高 安全性好的固体储氢材料 其储氢原理可表示为:Li2NH+H2
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2LiNH2+LiH,下列有关说法中正确的是 [ ]A Li2NH中N的化合价
碘具有升华的性质 利用该性质可用于指纹鉴定 因为A.汗液中有AgNO3 可以与碘生成黄色沉淀B.汗液
碘具有升华的性质,利用该性质可用于指纹鉴定,因为A.汗液中有AgNO3,可以与碘生成黄色沉淀B.汗液中有NaCl,可以与碘发生化学反应,有颜色变化C.根据
X Y Z和W代表原子序数依次增大的四种短周期主族元素 它们满足以下条件: ①X Y W分别位于不同
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件: ①X、Y、W分别位于不同周期;②在元素周期表中,Z与Y、W均相邻;③Y、Z、W三












