科技日报报道:辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势。从不同角度观察
科技日报报道:辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势。从不同角度观察MoS2的晶体结构见图。已知:Mo位于第五周期VIB族。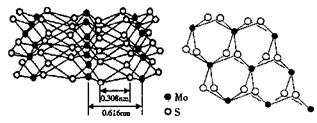 (1)晶体硅中硅原子的轨道杂化类型为______。 (2)电负性:C______S(填“>”或“<”)。 (3)晶体硅和C60比较,熔点较高的是______。 (4)Mo元素基态原子的价电子排布式为____________。 (5)根据MoS2的晶体结构回答: ①每个Mo原子周围距离最近的S原子数目为______。 ②Mo-S之间的化学键为______(填序号)。 A极性键;B非极性键;C配位键;D金属键;E范德华力 ③MoS2纳米粒子具有优异的润滑性能,其原因是______。 |
参考解答
| (13分)(1)sp3(1分) (2)< (2分) (3)晶体硅(2分) (4)4d45s1(2分) (5)①6(2分) ②AC(2分) ③MoS2具有层状结构,Mo与S同层间以共价键结合,层与层之间通过范德华力结合,外力作用层与层易发生相对滑动(2分) |
试题分析:(1)晶体硅中以正四面体结构为单元,说明硅原子采取sp3杂化方式;(2)最高价氧化物对应水化物酸性:H2CO3<H2SO4,则非金属性:C<S,所以电负性:C<S;(3)晶体硅是原子晶体,C60是分子晶体,则熔点:晶体硅>C60;(4)Mo位于第五周期VIB族,由能量最低原理、洪特规则可知,基态Mo原子的价电子排布式为4d45s1;(5)①读图可知,每个Mo原子周围距离最近的S由6个;Mo-S之间的化学键为极性键和配位键,故AC正确;MoS2具有层状结构,Mo与S同层间以共价键结合,层与层之间通过范德华力结合,外力作用层与层易发生相对滑动。 |
相似问题
Ⅰ.铬位于第四周期ⅥB族 主要化合价+2 +3 +6 单质硬度大 耐腐蚀 是重要的合金材料。(1)
Ⅰ 铬位于第四周期ⅥB族,主要化合价+2,+3 ,+6,单质硬度大,耐腐蚀,是重要的合金材料。(1)基态铬原子的价电子排布图___________,CrO2Cl2常温下为
下列说法正确的是A.Na Fe分别与不足量的稀硫酸反应所得溶液均呈中性B.将Ba(OH)2溶液滴到明
下列说法正确的是A.Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性B.将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以Al(OH)3的形式存在C.氢
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体 它能被“印”或“涂”在柔软塑料上 制成多种
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备。请回答下列问题:(1)O、S、Se
原子序数小于36的X Y Z W四种元素 元素X的原子核外最外层电子数是内层电子数的2倍 元素Y与X
原子序数小于36的X、Y、Z、W四种元素,元素X的原子核外最外层电子数是内层电子数的2倍,元素Y与X同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相
下列描述中正确的是A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中的空间构
下列描述中正确的是A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中的空间构型为正四面体形D.SiF4和SO32-的中心原子均为sp3杂化












