已知X Y和Z三种元素的原子序数之和等于48。X是有机物主要组成元素。X的一种1∶1型气态氢化物分子
| 已知X、Y和Z三种元素的原子序数之和等于48。X是有机物主要组成元素。X的一种1∶1型气态氢化物分子中既有σ键又有π键。Z是金属元素,Z的核电荷数小于28,且次外层有2个未成对电子。 (1)X在该氢化物中以 方式杂化。X和Y形成的化合物的熔点应该 (填“高于”或“低于”)X氢化物的熔点。 (2)Y在周期表中位于 ;Z4+的核外电子排布式为 。 (3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看作一种含氧酸盐)。经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。 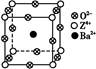 ①制备M的化学反应方程式是 (Z用元素符号表示)。 ②在M晶体中,Ba2+的氧配位数(Ba2+周围等距且最近的O2-的数目)为 。 ③晶体M密度的计算式为ρ= (Z相对原子质量为48)。 |
参考解答
| (1)sp 高于 (2)第4周期ⅡA族 1s22s22p63s23p6 (3)①TiO2+BaCO3 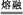 BaTiO3+CO2↑ ②12 BaTiO3+CO2↑ ②12③(137+48+3×16)/NA(4.03×10-8)3 g·cm-3 |
有机物的主要组成元素X为碳元素,Z元素次外层有2个未成对电子且核电荷数小于28,只能为过渡元素钛22Ti,位于周期表中第4周期ⅣB族。根据原子序数之和为48,可推知Y为20号元素钙。(1)X的该氢化物为乙炔,乙炔为直线形分子,碳原子以sp方式杂化,碳化钙是离子化合物,熔点高于碳的氢化物分子晶体熔点。(2)钙元素在周期表中第4周期ⅡA族。钛离子核外电子排布式为:1s22s22p63s23p6。(3)①用均摊法可以推出M的化学式为BaTiO3,制备BaTiO3化学方程式:TiO2+BaCO3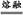 BaTiO3+CO2↑。②与钡离子紧邻等距的氧离子共有12个。③由1 mol该化合物的体积关系得: BaTiO3+CO2↑。②与钡离子紧邻等距的氧离子共有12个。③由1 mol该化合物的体积关系得: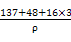 =(4.03×10-8)3NA,整理得ρ= =(4.03×10-8)3NA,整理得ρ=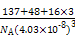 g·cm-3。 g·cm-3。 |
相似问题
卤族元素的单质和化合物很多 请利用所学物质结构与性质的相关知识回答下列问题:(1)卤族元素位于周期表
卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:(1)卤族元素位于周期表的 区;氟原子的电子排布图为溴原子的价电子排
纳米技术制成的金属固体燃料 氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量
纳米技术制成的金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子
Q R T X Y Z是六种原子序数依次增大的前四周期常见元素 其相关信息如下表:元素相关信息QQ的
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如下表:元素相关信息QQ的单质是实验室常用的惰性电极材料RR原子基态时2p原子轨
有a b c d f五种前四周期元素 原子序数依次增大 a b c三种元素的基态原子具有相同的能层和
有a、b、c、d、f五种前四周期元素,原子序数依次增大,a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b)且其中基态b原子的2
第4周期元素由于受3d能级电子的影响 性质的递变规律与短周期元素略有不同。Ⅰ.第4周期元素的第一电离
第4周期元素由于受3d能级电子的影响,性质的递变规律与短周期元素略有不同。Ⅰ 第4周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓(31Ga)的












