KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯.其反应可表述为:______KCl
| KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯.其反应可表述为: ______KClO3+______HCl(浓)→______KCl+______ClO2+______Cl2+______H2O (1)配平以上化学方程式(化学计量数填入划线上)并标出电子转移的方向和数目. (2)反应中的氧化剂是______,被氧化的元素是______,ClO2是反应的______(填氧化或还原)产物. (3)浓盐酸在反应中显示出来的性质是(填写号码)______ ①还原性②氧化性③酸性④碱性 (4)反应产生0.1molCl2,则转移的电子的物质的量为______mol (5)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的______倍(保留2位小数). |
参考解答
(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒,可知未知物是水,水的系数是2.电子转移的方向和数目为: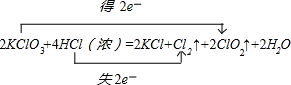 故答案为:2、4、2、1、2、2H2O; 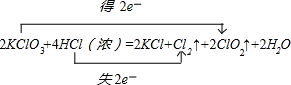 ; ;(2)KClO3氯元素的化合价降低,是氧化剂,对应的产物二氧化氯是还原产物,HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高,氯元素被氧化, 故答案为:KClO3;Cl;还原; (3)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各中一半, 故选:①③; (4)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol, 故答案为:0.2mol; (5)设质量都是71g,氯气得到的电子数为
ClO2得到的电子数为
则ClO2消毒的效率是Cl2的倍数为
故答案为:2.63. |
相似问题
金属钙线是炼制优质钢材的脱氧脱磷剂 某钙线的主要成分为金属M和Ca 并含有3.5%(质量分数)CaO
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3 5%(质量分数)CaO(1)Ca元素在周期表中位置是______,其原子结构示意图__
古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:NaClO+NH3?H2O→N2H4+NaC
古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:NaClO+NH3?H2O→N2H4+NaCl+H2O(1)请配平上述化学方程式.并用单线桥法标出电子转移的方向和数目
(1)①配平下列离子方程式:_____I-x+_____Cl2+_____H2O→____Cl-+_
(1)①配平下列离子方程式:_____I-x+_____Cl2+_____H2O→____Cl-+____IO3-+_______②在反应中,若消耗I-x与Cl2物质的量之比为1∶8,则x=___________。
用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4MnO2+K2O+O2(240 ℃)。下列说法不
用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4MnO2+K2O+O2(240 ℃)。下列说法不正确的是( )A.每生成16 g氧气转移4 mol电子B.相同质量的KMnO4分
(1)在反应MnO2 + 4HCl = MnCl2 + 2H2O +Cl2↑中 ①用双线桥法标出电子
(1)在反应MnO2 + 4HCl = MnCl2 + 2H2O +Cl2↑中,①用双线桥法标出电子转移的方向和数目:__________________________②还原剂是______________












