金属钙线是炼制优质钢材的脱氧脱磷剂 某钙线的主要成分为金属M和Ca 并含有3.5%(质量分数)CaO
| 金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO (1)Ca元素在周期表中位置是______,其原子结构示意图______. (2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为______,D的沸点比A与Si形成的化合物E的沸点______. (3)配平用钙线氧脱鳞的化学方程式:______P+______FeO+______CaO→______Ca3(PO4)2+______Fe (3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为______;检测Mn+的方法是______(用离子方程式表达). (5)取 1.6g钙线试样,与水充分反映,生成224ml H2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3______g. |
参考解答
(1)Ca是20号元素,钙原子核外电子数为20,有3个电子层,各层电子数为2、8、8、1,处于周期表中第四周期第ⅡA族,原子结构示意图为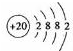 ,故答案为:第四周期第ⅡA族;  ; (2)最活跃的非金属元素A为F元素,钙与氟形成氟化钙,为离子化合物,电子式为 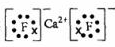 ,氟元素与Si形成的化合物为SiF4,SiF4是分子晶体,离子晶体的沸点高于分子晶体,故沸点CaF2>SiF4; 故答案为:  ;高; (3)反应中P磷元素的化合价由0价升高为+5价,总共升高10价,铁元素化合价由+2价降低为0价,总共降低2价,化合价升高最小公倍数为10,故Ca3(PO4)2系数为1,FeO的系数为5,P系数为2,CaO的系数为3,Fe的系数为5,故配平后方程式为2P+5FeO+3CaO=Ca3(PO4)2+2Fe,故答案为:2、5、3、1、2; (4)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,Fe3+与SCN-结合生成红色物质检验Fe3+,离子方程式为Fe3++3SCN-=Fe(SCN)3, 故答案为:Fe;Fe3++3SCN-=Fe(SCN)3; (5)224mlH2的物质的量为
故答案为:1.1. |
相似问题
古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:NaClO+NH3?H2O→N2H4+NaC
古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:NaClO+NH3?H2O→N2H4+NaCl+H2O(1)请配平上述化学方程式.并用单线桥法标出电子转移的方向和数目
(1)①配平下列离子方程式:_____I-x+_____Cl2+_____H2O→____Cl-+_
(1)①配平下列离子方程式:_____I-x+_____Cl2+_____H2O→____Cl-+____IO3-+_______②在反应中,若消耗I-x与Cl2物质的量之比为1∶8,则x=___________。
用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4MnO2+K2O+O2(240 ℃)。下列说法不
用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4MnO2+K2O+O2(240 ℃)。下列说法不正确的是( )A.每生成16 g氧气转移4 mol电子B.相同质量的KMnO4分
(1)在反应MnO2 + 4HCl = MnCl2 + 2H2O +Cl2↑中 ①用双线桥法标出电子
(1)在反应MnO2 + 4HCl = MnCl2 + 2H2O +Cl2↑中,①用双线桥法标出电子转移的方向和数目:__________________________②还原剂是______________
用15.8g KMnO4氧化75mL足量浓盐酸。反应方程式如下:2KMnO4 + 16HCl = 2
用15 8g KMnO4氧化75mL足量浓盐酸。反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑+ 8H2O(1)有多少克HCl被氧化?(2)若












