反应:L(s)+aG(g)bR(g) 达到平衡时 温度和压强对该反应的影响如图所示:图中压强p1>p
反应:L(s)+aG(g) bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。 bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。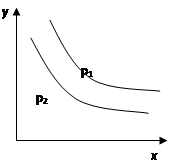 据此可判断( ) A.上述反应是放热反应 B.上述反应是吸热反应 C.a>b D.a +1<b |
参考解答
| B |
| 由图可知,随温度升高,G的体积分数减少,即升高温度平衡向正反应方向移动,即可得正反应方向为吸热反应,A错,B正确; 由图可知,随压强的增大,G的体积分数增大,即增大压强平衡向逆反应方向移动,即逆反应为气体体积减少的反应,得a <b,C、D均错; |
相似问题
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强
(6分)一定条件下 向某容器中加入2molA 2molB 使反应2A+mBnC+D达到平衡时 气体A
(6分)一定条件下,向某容器中加入2molA、2molB,使反应2A+mBnC+D达到平衡时,气体A的浓度为w mol L、体积分数为v%。(1)若容积不变,且B为固体,达到
下列有关“电离平衡”的叙述中正确的是A.电解质在溶液里达到电离平衡时 溶质电离出的离子浓度相等B.电
下列有关“电离平衡”的叙述中正确的是A.电解质在溶液里达到电离平衡时,溶质电离出的离子浓度相等B.电离平衡时,由于分子和离子的浓度不断发生变化,
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g) m
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g)mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正
在一密闭容器中进行可逆反应H2(g)+I2(g)?2 HI(g)并达到平衡 下列有关说法正确的是(
在一密闭容器中进行可逆反应H2(g)+I2(g)?2 HI(g)并达到平衡,下列有关说法正确的是()A.不论加多大压强,此化学平衡也不会移动B.升温,此化学












