一定条件下 体积为2L的密闭容器中 1mol A和1mo1 B进行反应:A(g)+3B(g)2C(g
一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:A(g)+3B(g)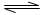 2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。 2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。 下列说法正确的是 A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min) B.反应开始至2分钟时,A的转化率为5% C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0 D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图 |
参考解答
| C |
A:v(C)=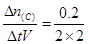 =0.05mol/(L.min),再根据反应物的系数比可知,v(B)=0.075mol/(L.min) =0.05mol/(L.min),再根据反应物的系数比可知,v(B)=0.075mol/(L.min)B:生成了0.2mol C,同必定有0.1molA转化,则A的转化率为10% C:升温,平衡向生成A的方向移动,则正反应为放热反应,△H<0 D:加压,平衡向正向移动,正反应速率相对较大,不正确 答案为C |
相似问题
反应 X(气)+ Y(气) 2Z(气);△H=Q(Q
反应 X(气)+ Y(气) 2Z(气);△H=Q(Q<0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是A.加催化
在10 L密闭容器中 1 mol A和3 mol B在一定条件下反应:A(气)+xB(气)2C(气)
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(气)+xB(气)2C(气),2min后反应达到平衡时,测得混合气体共3 4 mol,生成0 4 mol
在容积为2升的密闭容器中 有反应:mA(g)+nB(g)pC(g)+qD(g) 经过5分钟达到平衡
在容积为2升的密闭容器中,有反应:mA(g)+nB(g)pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速度VB
下列叙述中 不能用平衡移动原理解释的是A.红棕色的NO2 加压后颜色先变深后变浅B.高压比常压有利于
下列叙述中,不能用平衡移动原理解释的是A.红棕色的NO2,加压后颜色先变深后变浅B.高压比常压有利于合成SO3的反应C.加入催化剂有利于氨的合成D.工业
反应:xA(气)+yB(气)zC(气) 达到平衡时测得A气体的浓度为0.5 mol/L 当在恒温下将
反应:xA(气)+yB(气)zC(气),达到平衡时测得A气体的浓度为0 5 mol L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0 3 mol L,












