下列叙述中 不能用平衡移动原理解释的是A.红棕色的NO2 加压后颜色先变深后变浅B.高压比常压有利于
下列叙述中,不能用平衡移动原理解释的是
|
参考解答
| C |
| 略 |
相似问题
反应:xA(气)+yB(气)zC(气) 达到平衡时测得A气体的浓度为0.5 mol/L 当在恒温下将
反应:xA(气)+yB(气)zC(气),达到平衡时测得A气体的浓度为0 5 mol L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0 3 mol L,
一定条件下 在密闭容器内 SO2氧化成SO3的热化学方程式为:2SO2 (g) + O2 (g) 2
一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2 (g) + O2 (g) 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,
(12分)已知2SO2 (g)+ O2(g) 2SO3(g) △H =-196kJ·mol-1 50
(12分)已知2SO2 (g)+ O2(g) 2SO3(g)△H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如
将等物质的量的F2和ClF混合 在密闭容器中发生反应: F2(g)+ClF(g) ClF3(g);△
将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g) ClF3(g);△H<0。下列叙述中,正确的是A.恒温恒容时,当ClF 转化40% 时,容器内
9SO2是硫酸生产的重要中间产物 也是空气污染的主要原因之一 其氧化生成SO3的反应为: 2SO2(
9SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为: 2SO2(g)+O2(g)2SO3(g)。 ⑴将0.050 mol SO2(g)和0


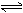 NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来









