(12分)已知2SO2 (g)+ O2(g) 2SO3(g) △H =-196kJ·mol-1 50
(12分)已知2SO2 (g)+ O2(g) 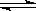 2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:高考 2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:高考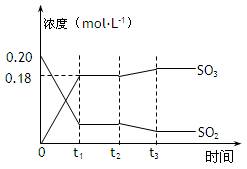 请回答下列问题: (1)用O2表示2分钟内该反应的平均反应速率为 mol·L-1·min-1。计算500℃时该反应的平衡常数K= 。 (2)上图表示该反应在时刻t1达到平衡后,时刻t2因改变某个条件而发生变化的情况: 图中时刻t2发生改变的条件可能是 (写一个即可)。 (3)在上述条件下起始装入的SO2和O2各2mol,达平衡后设SO2的转化率为x,列出求x的方程 。(不必求出x) (4)某温度时,该反应的平衡常数K=5000,则该温度 500℃(填“>”、“<”、“=”)。 (5)500℃时,若起始装入的SO2、O2和SO3分别为0.2mol、y mol、wmol,达到平衡时各组分的含量与第(3)完全相同,则y= mol。刚开始时反应向 (填“正”或“逆”)反应方向进行。 |
参考解答
| 共12分 (1)0.045mol﹒L-1﹒min-1 (2分),8100(2分) (2)降温或增加O2的浓度(2分),其它合理答案也给(2分) (3)x2/(1-x)2(2-x)=810(2分,其它合理形式给2分) (4)>(2分) (5)1.1、正(各1分) |
| 略 |
相似问题
将等物质的量的F2和ClF混合 在密闭容器中发生反应: F2(g)+ClF(g) ClF3(g);△
将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g) ClF3(g);△H<0。下列叙述中,正确的是A.恒温恒容时,当ClF 转化40% 时,容器内
9SO2是硫酸生产的重要中间产物 也是空气污染的主要原因之一 其氧化生成SO3的反应为: 2SO2(
9SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为: 2SO2(g)+O2(g)2SO3(g)。 ⑴将0.050 mol SO2(g)和0
N2(g)+3H2(g)==2NH3(g)在体积不变的密闭容器中反应 下列叙述表示处于化学平衡状态的
N2(g)+3H2(g)==2NH3(g)在体积不变的密闭容器中反应,下列叙述表示处于化学平衡状态的是A.N2、H2、NH3的浓度比为1:3:2的状态B.混合气体的密度不随时间
将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g) 2C(g)ΔH
将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g) 2C(g)ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0 6 mol L。下列说法正确
(10分)830K时 在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g)
(10分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g) △H<0;试回答下列问题:(1)若起始时c(CO)="2" mol·L-1,c(












