镓(Ga) 锗(Ge) 砷(As) 硒(Se)均为第四周期的元素 它们在高科技尖端科学特别是信息领域
| 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题: (1)基态锗原子的价电子排布式为_________________________________。 (2)沸点:NH3________AsH3(填“>”、“<”或“=”,原因是_____________________。 (3)某砷的氧化物俗称“砒霜”,其分子结构如图所示,该化合物的分子式为_______,As原子采取__________杂化。 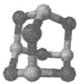 (4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________。 (5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为_________________;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm,则每立方厘米该晶体中所含砷元素的质量为____________g(用NA表示阿伏加德罗常数的值)。 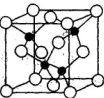 |
参考解答
| (1)4s24p2(1分) (2)>(1分,写“大于”不得分) NH3分子间存在氢键,所以NH3沸点高于AsH3 (2分,只要指明NH3分子间存在氢键即可) (3)As4O6(1分) sp3(1分) (4)H2SeO4和H3SeO3可表示为(HO)2SeO2和(HO)3Se,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+(2分,合理答案即可) (5)(CH3)3Ga + AsH3 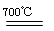 GaAs + 3CH4(2分,不写反应条件不扣分,化学式写错、不配平不得分); GaAs + 3CH4(2分,不写反应条件不扣分,化学式写错、不配平不得分);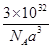 (2分,合理答案即可) (2分,合理答案即可) |
试题分析:(1)锗是第四周期第ⅣA族元素,原子序数是32,所以依据核外电子排布规律可知,基态锗原子的价电子排布式为4s24p2; (2)由于氮元素的非金属性强,因此NH3分子间存在氢键,所以NH3沸点高于AsH3沸点; (3)根据分子结构可知,分子内含有6个氧原子,4个砷原子,化学式为As4O6。由于每个As原子形成3个共价键,又因为中心原子还有1对孤对电子,所以采用的是sp3杂化; (4)由于H2SeO4和H3SeO3可表示为(HO)2SeO2和(HO)3Se,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+,所以H2SeO4比H2SeO3酸性强; (5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,则根据原子守恒可知,另外一种生成物是甲烷,则该反应的方程式为(CH3)3Ga + AsH3  GaAs + 3CH4;根据晶胞结构可知GaAs晶体中,每个As与4个Ga相连,且As原子全部在晶胞里面,共计是4个。晶胞边长为a pm,所以晶胞的体积 GaAs + 3CH4;根据晶胞结构可知GaAs晶体中,每个As与4个Ga相连,且As原子全部在晶胞里面,共计是4个。晶胞边长为a pm,所以晶胞的体积是a3pm3,所以每立方厘米含该晶胞的个数是 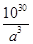 ,因此含有的As原子个数是 ,因此含有的As原子个数是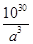 ×4,物质的量是 ×4,物质的量是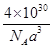 mol,所以As元素的质量是 mol,所以As元素的质量是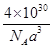 mol×75g/mol= mol×75g/mol=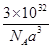 g。 g。 |
相似问题
已知大多数含氧酸可用通式XOm(OH)n来表示 如X是S 则m=2 n=2 则这个式子就表示H2SO
已知大多数含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大于等于2的是强酸,m为0的是弱酸。下列各含氧
(15分)【化学——选修3:物质结构与性质】Ⅰ.顺铂是美国教授B Rosenberg等人于1969年
(15分)【化学——选修3:物质结构与性质】Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2
能源 材料和信息是现代社会的三大“支柱”。(1)目前 利用金属或合金储氢的研究已取得很大进展 下图是
能源、材料和信息是现代社会的三大“支柱”。(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。① Ni原子的价
A B C D E为原子序数依次增大的短周期元素 已知A B E 3种原子最外层共有11个电子 且这
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和
已知X Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子 Y元素原子的最
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元












