已知X Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子 Y元素原子的最
| 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题: (1)X元素原子基态时的电子排布式为 ,该元素的符号是 。 (2)Y元素原子的电子排布图为 ,元素X与Y的电负性比较:X Y(填“>”或“<”)。 (3)X与Z可形成化合物XZ3,该化合物的空间构型为 。 (4)由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构如图所示。(黑球位于立方体内,白球位于立方体顶点和面心) 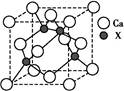 请写出化合物A的化学式 ;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为 。 (5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为 。 |
参考解答
| (1)1s22s22p63s23p63d104s24p3 (其他合理答案也给分) As (2) 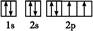 < <(3)三角锥形 (4)GaAs (CH3)3Ga+AsH3 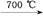 GaAs+3CH4 GaAs+3CH4(5)sp2杂化 |
| X的最外层电子排布为4s24p3,故为33As;2p轨道有两个未成对电子,可能是6C或8O,因Y能够与砷形成As2Y3化合物,故Y为8O;As、O、Z的原子序数之和为42,故Z为1H。 (2)周期表中氧元素在砷元素的右上方位置,故电负性氧大于砷。 (3)AsH3的结构与氨相似,为三角锥形。 (4)As位于晶胞内,有4个。Ga的个数为:8×1/8+6×1/2=4,故化学式为GaAs。 (5)因分子为非极性分子,故空间结构对称,Ga原子处于正三角形的中心,而三个C原子位于三角形的三个顶点上。中心原子Ga为sp2杂化。 |
相似问题
A B C D 4种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相
A,B,C,D 4种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5 8 g B的氢氧化物恰好能与 100 mL
(6分)X Y Z R为前四周期元素 且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3
(6分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个
原子序数依次增大的四种元素A B C D分别处于第一至第四周期 自然界中存在多种A的化合物 B原子核
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分
已知A B C D E是短周期中的五种非金属元素 它们的原子序数依次增大。A元素原子形成的离子核外电
已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子
Ⅰ.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。(1)基态镍原子的价电子(外围电子)排布式为
Ⅰ 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。(1)基态镍原子的价电子(外围电子)排布式为 。(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为












