能源 材料和信息是现代社会的三大“支柱”。(1)目前 利用金属或合金储氢的研究已取得很大进展 下图是
| 能源、材料和信息是现代社会的三大“支柱”。 (1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。 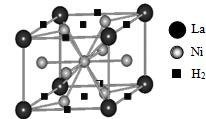 ① Ni原子的价电子排布式是 。 ② 该合金储氢后,含1mol La的合金可吸附H2的数目为 。 (2)南师大结构化学实验室合成了一种多功能材料——对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。 ①晶体中四种基本元素的电负性由大到小的顺序是 。 ②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是 。 (3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是 ,其中心原子N的杂化方式是 。 (4)在金刚石晶体的一个晶胞(如图1)中,含有 个碳原子。在二氧化硅晶体的一个晶胞中,含有 个化学键。原子晶体能否形成最密堆积结构,原因是 。 (5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是 。 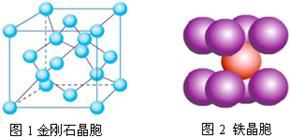 |
参考解答
 |
| (1)①Ni是28号元素,其核外有28个电子,镍原子3d、4s能级上电子为其价电子,根据构造原理知Ni原子的价电子排布式为3d84s2。 ②该晶胞中氢气分子个数=8×1/4+2×1/2=3,La原子个数是8×1/8=1,故该物质中氢分子和La原子个数比是3:1,则含1mol La的合金可吸附H2的数目为3NA。(2)①元素的非金属性越强其电负性越强,O、N、C、H的非金属性逐渐减弱,所以O、N、C、H的电负性逐渐减弱,则O、N、C、H的电负性由大到小的顺序是O>N>C>H。 ②对硝基苯酚水合物之间氧原子和氢原子间存在氢键,所以对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是氢键,故答案为:氢键; (3)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO43-,其电子式为: 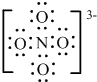 ,该离子中价层电子对=4+1/2(5+3-4×2)=4,所以N原子采用sp3杂化。 ,该离子中价层电子对=4+1/2(5+3-4×2)=4,所以N原子采用sp3杂化。(4)在金刚石晶胞中含有碳原子数为 8×1/8+6×1/2+4=8;在二氧化硅晶胞中,它的结构与金刚石相似,一个Si结合4个氧,所以共有32个化学键。原子晶体是原子之间是以共价键结合的,共价键有饱和性和方向性,一个原子不能形成12条共价键,所以原子晶体就不能形成配位数是12的最密堆积结构。 (5)图2中为铁的体心立方结构,晶胞中含有Fe原子数目是2,其晶胞质量是,2×56/NA,铁原子半径为r,边长为a,则3a2=(4r)2,a= 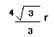 ,晶胞的体积是V=( ,晶胞的体积是V=(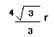 cm)3,故其密度是 g/cm3。 cm)3,故其密度是 g/cm3。 |
相似问题
A B C D E为原子序数依次增大的短周期元素 已知A B E 3种原子最外层共有11个电子 且这
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和
已知X Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子 Y元素原子的最
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元
A B C D 4种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相
A,B,C,D 4种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5 8 g B的氢氧化物恰好能与 100 mL
(6分)X Y Z R为前四周期元素 且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3
(6分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个
原子序数依次增大的四种元素A B C D分别处于第一至第四周期 自然界中存在多种A的化合物 B原子核
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分












