给出下列氧化还原反应 试回答下列问题.(1)KMnO4+KI+H2SO4→K2SO4+MnSO4+I
| 给出下列氧化还原反应,试回答下列问题. (1)KMnO4+KI+H2SO4→K2SO4+MnSO4+I2十 H2O配平化学反应方程式______被还原的元素______,发生氧化反应的物质______. (2)3Cl2+6NaOH═5NaCl+NaClO3+3H2O用双线桥标出电子转移的方向和数目______氧化剂与还原剂的物质的量之比为______,氧化产物是______. (3)11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价).该反应中Cu2+表现______性(填氧化或还原);11molP中被P氧化的P是______mol. |
参考解答
| (1)反应中锰元素的化合价从+7价降为+2价,共降低了5价,碘元素的化合价从-1价升高到了0价,生成单质碘的所有碘元素共升高了2价,氧化还原反应中得失电子数相等,所以高锰酸钾前面的系数为2,碘化钾前面的系数为10,根据原子守恒来配平其他物质前面的系数,即2KMnO4+10KI+8H2SO4═6K2SO4+2MnSO4+5I2十8H2O, 故答案为:2KMnO4+10KI+8H2SO4═6K2SO4+2MnSO4+5I2十8H2O,Mn,KI; (2)在反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O中,化合价升高和降低的元素均是氯元素,在反应的3mol氯气中,有
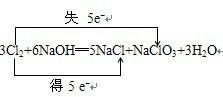 , 故答案为:  ,5:1,NaClO3; (3)在反应11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价)中Cu2+化合价降为+1价,所以 Cu2+做氧化剂,具有氧化性,在反应的11molP中,有6molP化合价升高,被氧化,所以被P氧化的P是6mol,故答案为:氧化;6. |
相似问题
Cl2和一定浓度的KOH反应 生成KCl KClO3 KClO和H2O.当ClO-3与ClO-的物质
Cl2和一定浓度的KOH反应,生成KCl、KClO3、KClO和H2O.当ClO-3与ClO-的物质的量之比为2:5时,被氧化的氯与被还原的氯的物质的量之比为( )A.1:7B
ClO2是一种消毒杀菌效率高 二次污染小的水处理剂.欧洲一些国家用NaClO3和浓盐酸反应来制取Cl
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.欧洲一些国家用NaClO3和浓盐酸反应来制取ClO2:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.下列判断不正
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )A.2NaBr+Cl2=2NaCl+Br2B.AlCl3+3N
LiAlH4() LiH是金属储氢材料 又是有机合成中的常用试剂 遇水均能剧烈反应释放出H2 LiA
LiAlH4()、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )A
标明下列反应的电子转移方向和数目.4HCl(浓)+MnO2 △ . Cl2↑+MnCl2+2H2
标明下列反应的电子转移方向和数目.4HCl(浓)+MnO2△ Cl2↑+MnCl2+2H2O其中______是氧化剂,______是还原剂,______元素被还原.氧化性强弱:MnO2_____












