如图中 A是氯气的发生装置 B C是净化气体的装置 D中装铁丝网;反应后E的底部有棕色固体聚集;F是
如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.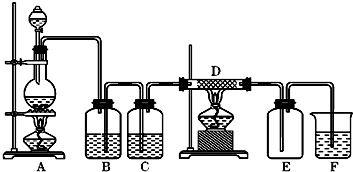 (1)上述装置中有一处错误,请指出是______处(用字母表示). (2)通过B是为了除去______,在B中应加入______;通过C是为了除去______. (3)写出D、F中发生反应的化学方程式______、______. (4)如果A中产生氯气3.36L(标准状况),请计算: ①写出A中方程式,并用双线桥法分析A中的电子转移情况______. ②消耗MnO2的物质的量______. ③被氧化的HCl的物质的量______. |
参考解答
| (1)B装置是除去氯气中含杂质气体氯化氢,装置中导管短进长出,洗气装置除杂质要遵循长进短出,所以B装置错误;故答案为:B; (2)浓盐酸有挥发性,所以氯气中含有氯化氢气体,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体;水蒸气和铁在高温的条件下反应干扰实验,利用浓硫酸的吸水性,且不和氯气反应,用浓硫酸干燥氯气, 故答案为:HCl;饱和食盐水;水蒸气; (3)氯气有强氧化性,能把变价金属氧化成最高价态,所以氯气和铁反应的生成物是氯化铁;氯气有毒,污染环境,所以不能排空,氯气能和氢氧化钠反应生成氯化钠、次氯酸钠、水,所以可用氢氧化钠吸收多余的氯气, 故答案为:2Fe+3Cl2
(4)①氧化还原反应根据氧化剂和还原剂可以分为:完全氧化还原反应和部分氧化还原反应,这是一个部分氧化还原反应,化合价降低元素是Mn元素,二氧化锰为氧化剂,化合价升高元素是Cl元素,HCl是还原剂,但氯化氢部分(50%)被氧化,故答案为: 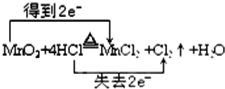 ; ②由反应MnO2+4HCl(浓)
故答案为:0.15mol; ③由反应MnO2+4HCl(浓)
故答案为:0.3mol. |
相似问题
给出下列氧化还原反应 试回答下列问题.(1)KMnO4+KI+H2SO4→K2SO4+MnSO4+I
给出下列氧化还原反应,试回答下列问题.(1)KMnO4+KI+H2SO4→K2SO4+MnSO4+I2十H2O配平化学反应方程式______被还原的元素______,发生氧化反应的物质___
Cl2和一定浓度的KOH反应 生成KCl KClO3 KClO和H2O.当ClO-3与ClO-的物质
Cl2和一定浓度的KOH反应,生成KCl、KClO3、KClO和H2O.当ClO-3与ClO-的物质的量之比为2:5时,被氧化的氯与被还原的氯的物质的量之比为( )A.1:7B
ClO2是一种消毒杀菌效率高 二次污染小的水处理剂.欧洲一些国家用NaClO3和浓盐酸反应来制取Cl
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.欧洲一些国家用NaClO3和浓盐酸反应来制取ClO2:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.下列判断不正
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )A.2NaBr+Cl2=2NaCl+Br2B.AlCl3+3N
LiAlH4() LiH是金属储氢材料 又是有机合成中的常用试剂 遇水均能剧烈反应释放出H2 LiA
LiAlH4()、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )A












