有A B C D E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电
| 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的内部各能层均排满,且有成单电子;D与E同周期,价电子数为2。则: (1)写出基态E原子的价电子排布式 。 (2)A的单质分子中 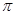 键的个数为 。 键的个数为 。(3)A、B、C三种元素第一电离能由大到小的顺序为 (用元素符号表示) (4)B元素的氢化物的沸点是同族元素中最高的,原因是 。 (5)A的最简单氢化物分子的空间构型为 ,其中A原子的杂化类型是 。 (6)C和D形成的化合物的晶胞结构如图,已知晶体的密度为 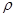 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用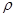 、NA的计算式表示) 、NA的计算式表示)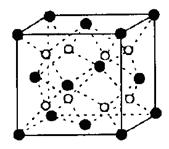 |
参考解答
| (1)3d104s1(2分) (2)2(2分) (3)F>N>O (2分) (4)H2O分子间存在氢键(2分) (50三角锥形 (2分) sp3(2分) (6) 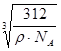 (3分) (3分) |
试题分析:有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,所以C是F元素,则B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素, (1)E是Cu元素,基态Cu原子的价电子排布式 3d104s1答案: 3d104s1;⑵A是N元素,氮气的结构式为:N≡N,所以氮气分子中含有一个σ键两个π键,故答案为:2; (3)同一周期中,元素的第一电离能随着原子序数的增大而增大,但第VA族元素第一电离能大于第VIA族元素,所以A、B、C三元素第一电离能由大到小的顺序为F>N>O,故答案为:F>N>O; ⑷ O元素的氢化物的沸点是同族元素中最高的,水分子间能形成氢键导致其沸点最高,答案:水分子间可以形成氢键; ⑸N元素的简单氢化物是氨气,NH3分子中氮原子价层电子对=3+1=4,且含有一个孤电子对,所以分子空间构型是三角锥型,采取sp3杂化,答案为:三角锥型;sp3. ⑹C和D形成的离子化合物为CaF2,钙离子在晶胞中占据顶点和面心,含有的钙离子为8× 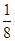 +6× +6×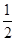 =4,则其质量为 =4,则其质量为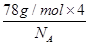 ,离子化合物晶胞的边长为a cm,其体积为a3,由ρ= ,离子化合物晶胞的边长为a cm,其体积为a3,由ρ=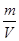 可知,ρV='m,' 可知,ρV='m,' 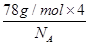 =a3cm3×ρg·cm-3,a= =a3cm3×ρg·cm-3,a=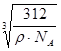 ,故答案为: 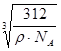 |
相似问题
某元素R的气态氢化物化学式为H2R 则R的最高价氧化物对应水化物的化学式是[ ]A.HRO3
某元素R的气态氢化物化学式为H2R,则R的最高价氧化物对应水化物的化学式是[ ]A.HRO3B.H2RO3 C.H2RO4 D.H3RO4
X Y Z Q W为按原子序数由小到大排列的五种短周期元素 已知:①x元素与Q处于同一主族 其原子价
X、Y、Z、Q、W为按原子序数由小到大排列的五种短周期元素,已知:①x元素与Q处于同一主族,其原子价电子排布式都为ns2np2,且x原子半径小于Q的原子半径;
有A B C D E F六种元素 A是周期表中原子半径最小的元素 B是电负性最大的元素 C的2p轨道
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数
A B C D E F六种短周期元素的原子序数依次增大 已知:①A原子核内只有1个质子;②B原子最外
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次
研究物质的微观结构 有助于人们理解物质变化的本质。请回答下列问题:(1)C Si N元素的电负性由大
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:(1)C、Si、N元素的电负性由大到小的顺序是___________________________,C60和金












