研究物质的微观结构 有助于人们理解物质变化的本质。请回答下列问题:(1)C Si N元素的电负性由大
| 研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题: (1)C、Si、N元素的电负性由大到小的顺序是___________________________, C60和金刚石都是碳的同素异形体,二者相比,熔点高的是________,原因是____________________________。 (2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:________________。
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+________(填“无”或“有”)颜色。 (4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。 ①COCl2分子的结构式为 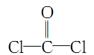 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是________。 |
参考解答
| (1)N>C>Si 金刚石 金刚石为原子晶体,C60为分子晶体 (2)1s22s22p63s2 (3)有 (4)①3 1 sp2 ②金属键 |
| (1)非金属性越强,元素电负性越大,根据三种元素在元素周期表中的位置,可知它们的电负性关系是N>C>Si。C60是分子晶体,金刚石是原子晶体,金刚石的熔点较高。(2)从表中电离能数值来看,A、B的第三电离能出现突跃,可见它们是第ⅡA族元素,因A、B均为短周期元素,且B的第一、二电离能均比A的小,故B是镁。(3)Mn2+的3d轨道有5个电子,故[Mn(H2O)62+有颜色。(4)①单键是σ键,双键中有一个σ键和一个π键。因碳、氧形成双键,故碳原子采取的是sp2杂化。②Fe(CO)5的配位键是铁原子与CO形成的,分解产物CO的化学键并未改变,生成了铁单质,故形成的化学键是金属键。 |
相似问题
某元素X的最高价含氧酸的化学式为HnXO2n-2 在气态氢化物中 X元素的化合价为( )A.5n-
某元素X的最高价含氧酸的化学式为HnXO2n-2,在气态氢化物中,X元素的化合价为( )A.5n-12B.3n-12C.3n-6D.n-10
VA族的氮 磷 砷(As)等元素在化合物中常表现出多种氧化态 含VA族元素的化合物在研究和生产中有许
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:(1)白磷单质的中P原子
下列说法正确的是 ( )A.H2O的熔点 沸点大于H2S的是由于H2O分子之间存在氢键。B.HF
下列说法正确的是 ()A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。B.HF、HCl、HBr、HI的熔点沸点依次升高。C.乙醇分子与水分子之间只存
常压下 苯的沸点低于甲苯 熔点却高于甲苯。苯的熔点更高的原因可能是 A.苯具有芳香性B.苯中的化学键
常压下,苯的沸点低于甲苯,熔点却高于甲苯。苯的熔点更高的原因可能是 A.苯具有芳香性B.苯中的化学键强度更强C.苯分子间作用力更小D.固态时苯分子
氮 磷 锌是与生命活动密不可分的元素。请回答下列问题:(1)NH3和pH3都是极性分子 其中极性较大
氮、磷、锌是与生命活动密不可分的元素。请回答下列问题:(1)NH3和pH3都是极性分子,其中极性较大的是______,理由是______。(2)NH4NO3是一种重要的化学












