有A B C D E F六种元素 A是周期表中原子半径最小的元素 B是电负性最大的元素 C的2p轨道
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题: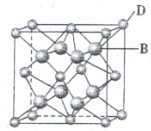 (1)E+离子基态时的电子排布式为_______________ (2)A2F的分子空间构型为_____________,FO3分子中F原子的杂化方式 ______________ (3)CA3极易溶于水,其原因主要是______________ (4)从图中可以看出,D 与B形成的离子化合物的化 学式为______________(用元素符号表示),该离子晶体的 密度为ag·cm-3,则晶胞的体积是____________(写出表达式即可,不用化简) (5)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则 E的晶体中E原子的配位数为 |
参考解答
| (15分) (1)1s22s22p63s23p63d10或[Ar3d10(2分) (2) V形 sp2 (各2分) (3)NH3分子与H2O 分子间形成氢键(2分) (4)CaF2(2分) 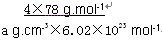 (3分) (5)12(2分) (3分) (5)12(2分) |
试题分析: 有A、B、C、D、E、F六种元素,A为氢元素; B为氟元素; C为氮元素; F为硫元素; E为Cu元素,D与B可形成离子化合物,由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8× 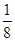 +6× +6×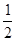 =4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素, =4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素,(1)E是Cu元素,是29号元素,原子基态时的电子排布式为[Ar3d104s1; (2)A2F分子是H2S,S原子成2个S-H键,含有2对孤对电子对,杂化轨道数目为4,采取sp3杂化; (3)NH3中N元素的电负性很强,与水分子之间形成氢键,且二者都是极性分子,故氨气极易溶于水, (4)由晶胞结构图可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为: 8× 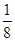 +6× +6×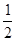 =4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为CaF2,晶胞的质量为 =4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为CaF2,晶胞的质量为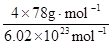 ,晶体的密度为ρ(g?cm-3),则晶胞的体积是 ,晶体的密度为ρ(g?cm-3),则晶胞的体积是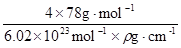 ; ;(5)Cu单质为面心立方最密堆积,以面心上的Cu为中心可以做三个切面,每个切面上有四个Cu原子,则Cu原子的配位数为12个。 考点定位:本题考查了位置结构性质的相互关系应用;原子核外电子排布;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断;化学键和等知识,题目综合性较大,难度较大,。 |
相似问题
A B C D E F六种短周期元素的原子序数依次增大 已知:①A原子核内只有1个质子;②B原子最外
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次
研究物质的微观结构 有助于人们理解物质变化的本质。请回答下列问题:(1)C Si N元素的电负性由大
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:(1)C、Si、N元素的电负性由大到小的顺序是___________________________,C60和金
某元素X的最高价含氧酸的化学式为HnXO2n-2 在气态氢化物中 X元素的化合价为( )A.5n-
某元素X的最高价含氧酸的化学式为HnXO2n-2,在气态氢化物中,X元素的化合价为( )A.5n-12B.3n-12C.3n-6D.n-10
VA族的氮 磷 砷(As)等元素在化合物中常表现出多种氧化态 含VA族元素的化合物在研究和生产中有许
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:(1)白磷单质的中P原子
下列说法正确的是 ( )A.H2O的熔点 沸点大于H2S的是由于H2O分子之间存在氢键。B.HF
下列说法正确的是 ()A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。B.HF、HCl、HBr、HI的熔点沸点依次升高。C.乙醇分子与水分子之间只存












