工业上用闪锌矿(主要成分为ZnS 还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下: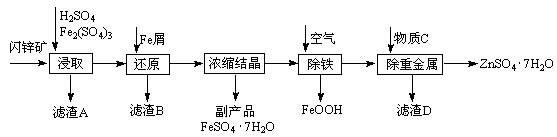 (1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。 (2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。 (3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。 (4)置换法除重金属离子所用物质C为 。 (5)硫酸锌的溶解度与温度之间的关系如下表:
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。 |
参考解答
| (1)S(2分) (2)做氧化剂(2分) Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S(3分) (3)4Fe2++O2+6H2O=4FeOOH+8H+(3分) 增大空气与溶液的接触面积,加快反应速率(2分) (4)Zn(锌)(2分) (5)60℃条件下蒸发浓缩、降温结晶(2分) |
试题分析:(1)依据流程转化关系分析判断,加入的硫酸铁具有氧化性能溶解氧化硫化锌、硫化镉,从滤渣A中可获得一种淡黄色非金属单质的副产品为氧化产物为硫,故答案为:S; (2)依据流程反应和生成硫单质可知,硫酸铁具有氧化性能氧化硫化锌和 硫化镉,生成单质硫,反应的化学方程式为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S,故答案为:做氧化剂; Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S; (3)除铁过程控制溶液的pH在5.4左右,利用空气中氧气氧化亚铁离子生成FeOOH,反应的两种方程式为:4Fe2++O2+6H2O=4FeOOH+8H+;在空气入口处设计了一个类似淋浴喷头的装置是为了增大与空气的接触面积增大反应速率,故答案为:4Fe2++O2+6H2O=4FeOOH+8H+;增大空气与溶液的接触面积,加快反应速率; (4)制备实验方案是制取ZnSO4?7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间,所以加入锌可以置换镉,故答案为:Zn; (5)依据图表中硫酸锌的溶解度与温度之间的关系分析,低温和高温溶解度都不是最大,只有在60°C硫酸锌的溶解度最大74.8g,通过加热蒸发浓缩,冷却结晶会最大程度得到晶体, 故答案为:60℃条件下蒸发浓缩、降温结晶.。 |
相似问题
为提纯下列物质 所选除杂试剂和分离的主要操作方法都合理的是选项被提纯的物质(杂质)除杂试剂主要操作方
为提纯下列物质,所选除杂试剂和分离的主要操作方法都合理的是选项被提纯的物质(杂质)除杂试剂主要操作方法ANaHCO3溶液(Na2CO3)澄清石灰水过滤BNaCl
下列实验装置一般不用于分离物质的是 ( )
下列实验装置一般不用于分离物质的是 ( )
钒的用途十分广泛 有金属“维生素”之称。某工厂为了从含有杂质的VOSO4样品中回收得到催化剂V2O5
钒的用途十分广泛,有金属“维生素”之称。某工厂为了从含有杂质的VOSO4样品中回收得到催化剂V2O5,设计流程如下:请回答下列问题:(1)步骤①所得废渣
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg 流程如下图所示:(1)工业制取镁的方法
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示:(1)工业制取镁的方法是法。(2)试剂Ⅰ一般选用(填化学式)。(3)下
多晶硅(硅单质的一种)被称为“微电子大厦的基石” 制备中副产物以SiCl4为主 它环境污染很大 能遇
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解












