多晶硅(硅单质的一种)被称为“微电子大厦的基石” 制备中副产物以SiCl4为主 它环境污染很大 能遇
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2 ? 2H2O,工艺流程如下: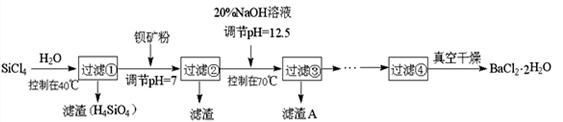 已知: ① 常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4; ② BaCO3的相对分子质量是197; BaCl2 ? 2H2O的相对分子质量是244; (1)SiCl4发生水解反应的化学方程式__________________________________ (2)高温下,SiCl4 (g) 用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收 59 kJ热量,则该反应的热化学方程式为__________________________________ (3)加钡矿粉调节pH=7的作用是: ①使BaCO3转化为BaCl2 ②_______________________________ (4)生成滤渣A的离子方程式________________________________________ (5)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2 ? 2H2O (6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2 ? 2H2O___________吨。 |
参考解答
| (1)SiCl4+4H2O=H4SiO4↓+4HCl (2分,写成H2SiO3且配平可给1分) (2)SiCl4(g)+2H2(g)=Si(s)+4HCl(g) △H= +236 kJ/mol (2 分) (3)使Fe3+ 完全沉淀 (1分) (4)Mg2++2OH- = Mg(OH)2↓( 1分) (5)蒸发浓缩,降温结晶(2分) (6)9.76 (2 分) |
试题分析:(3)常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4,加钡矿粉调节pH=7的另一作用为使Fe3+ 完全沉淀 (6)反应关系式为 BaCO3~BaCl2·2H2O 197 244 10×78.8% m m= 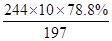 =9.76吨 =9.76吨 |
相似问题
氨基甲酸铵(NH2COONH4)是一种白色固体 易分解 易水解 可用做肥料 灭火剂 洗涤剂等。某化学
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:2N
在有B离子存在的情况下 欲用试剂C来检验溶液中是否含有A离子 下表所加试剂C能够对A离子进行成功检验
在有B离子存在的情况下,欲用试剂C来检验溶液中是否含有A离子,下表所加试剂C能够对A离子进行成功检验的是(说明:在实验过程中不允许加热、过滤、萃取等
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时 对课本上的描述:“海带灼烧后的灰烬中碘元素以
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑问。久置KI固体被氧化变
碘元素对人的健康非常重要。下面是从海带灰中分离出单质碘(I2)的流程图。(1)过程①的实验操作名称是
碘元素对人的健康非常重要。下面是从海带灰中分离出单质碘(I2)的流程图。(1)过程①的实验操作名称是____________,____________。(2)上述过程中,
亚氯酸钠(NaClO2)主要用于棉纺 造纸业的漂白剂 也用于食品消毒 水处理等 亚氯酸钠受热易分解。
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:(1)












