海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg 流程如下图所示:(1)工业制取镁的方法
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示: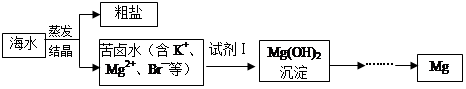 (1)工业制取镁的方法是 法。 (2)试剂Ⅰ一般选用 (填化学式)。 (3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。 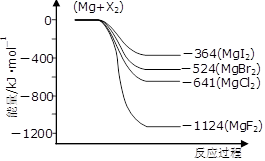 ①由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”、“=”或“<”)。 ②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 。 (4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 。 (5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因 。 |
参考解答
| (1)电解法或电解熔融氯化镁 (2)Ca(OH)2(该空1分) (3)①放热(该空1分),< ②MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) △H=-117KJ·mol—1 (4)CH3MgCl+H2O=CH4↑+Mg(OH)Cl↓或2CH3MgCl+2H2O=2CH4↑+Mg(OH)2↓+MgCl2 (5)Mg(OH)2(s)  Mg2+(aq)+2OH¯(aq),向Mg(OH)2中加入NH4Cl溶液后,铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,从而沉淀溶解。 Mg2+(aq)+2OH¯(aq),向Mg(OH)2中加入NH4Cl溶液后,铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,从而沉淀溶解。 |
试题分析:(1)镁是活泼的金属,工业制取镁的方法是电解熔融的氧化镁,即电解法冶炼镁。 (2)要将溶液中的Mg2+转化为氢氧化镁沉淀,需要加入碱。考虑试剂的来源和经济效益,一般加入的是氢氧化钙,化学式为Ca(OH)2。 (3)①由图可知反应物的总能量均高于生成物的总能量,所以Mg与卤素单质的反应均为放热反应。镁与单质氟反应放出的热量最多,则生成的MgF2稳定性最强,所以化合物的热稳定性顺序为MgI2<MgF2。 ②根据图像可知,Mg(s)+Cl2(g)=MgCl2(s) △H=-641kJ/mol、Mg(s)+Br2(l)=MgBr2(s) △H=-524kJ/mol,则根据盖斯定律可知,前者减去后者即得到反应MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l),所以该反应的反应热△H=-641kJ/mol+524kJ/mol=-117KJ/mol。 (4)CH3MgCl易与水发生水解反应并有无色无味气体生成,则该气体应该是甲烷。所以根据原子守恒可知,另外的生成物是碱式氯化镁,因此CH3MgCl水解的化学方程式为CH3MgCl+H2O=CH4↑+Mg(OH)Cl↓或2CH3MgCl+2H2O=2CH4↑+Mg(OH)2↓+MgCl2。 (5)氢氧化镁溶于水存在溶解平衡Mg(OH)2(s)  Mg2+(aq)+2OH¯(aq),铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,沉淀溶解。 Mg2+(aq)+2OH¯(aq),铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,沉淀溶解。 |
相似问题
多晶硅(硅单质的一种)被称为“微电子大厦的基石” 制备中副产物以SiCl4为主 它环境污染很大 能遇
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解
氨基甲酸铵(NH2COONH4)是一种白色固体 易分解 易水解 可用做肥料 灭火剂 洗涤剂等。某化学
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:2N
在有B离子存在的情况下 欲用试剂C来检验溶液中是否含有A离子 下表所加试剂C能够对A离子进行成功检验
在有B离子存在的情况下,欲用试剂C来检验溶液中是否含有A离子,下表所加试剂C能够对A离子进行成功检验的是(说明:在实验过程中不允许加热、过滤、萃取等
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时 对课本上的描述:“海带灼烧后的灰烬中碘元素以
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑问。久置KI固体被氧化变
碘元素对人的健康非常重要。下面是从海带灰中分离出单质碘(I2)的流程图。(1)过程①的实验操作名称是
碘元素对人的健康非常重要。下面是从海带灰中分离出单质碘(I2)的流程图。(1)过程①的实验操作名称是____________,____________。(2)上述过程中,












