某反应体系的物质有:H2SO4 KMnO4 MnSO4 CO2 K2C2O4 K2SO4 H2O.(
| 某反应体系的物质有:H2SO4、KMnO4、MnSO4、CO2、K2C2O4、K2SO4、H2O.(已知CO2为生成物) (1)将上述物质填入以下空格内,组成一个配平的化学反应方程式,并标出电子转移数目.  (2)上述反应中,被氧化的元素是______,氧化产物是______. (3)当有1mol的氧化剂参加反应时,转移的电子数是______mol. |
参考解答
| (1)高锰酸钾有强氧化性,所以选高锰酸钾作氧化剂,K2C2O4中C的化合价为+3价,CO2中C的化合价为+4价,要选择失电子的物质作还原剂,所以选,K2C2O4作还原剂,由高锰酸钾生成硫酸锰需硫酸参加反应,根据反应前后元素守恒,水在生成物中. 该反应中化合价的变化为:KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,所以得失电子的最小公倍数为10,所以KMnO4的计量数为2,K2C2O4的计量数为5,其它元素根据原子守恒配平. 故答案为: 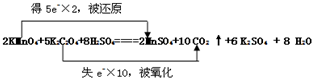 (2)该反应中,K2C2O4→CO2,C元素由+3价→+4价,所以K2C2O4是还原剂,碳元素被氧化,氧化产物是CO2; 故答案为:碳; CO2. (3)2KMnO4+5K2C2O3+8H2SO4=2MnSO4+10CO2+8H2O+6K2SO4 转移电子 2mol 10mol 1mol 5mol 故答案为:5. |
相似问题
标准状况下 a L Cl2通入到1 Lb mol/L的FeI2溶液中 充分反应后 所得溶液中Fe2+
标准状况下,a L Cl2通入到1 Lb mol L的FeI2溶液中,充分反应后,所得溶液中Fe2+的物质的量浓度与a、b的关系如下表,请完成其余空格。a、b的关系Fe2
(1)写出实验室制NH3的反应方程式为______;(2)硝酸具有强氧化性 它能和许多物质发生反应.
(1)写出实验室制NH3的反应方程式为______;(2)硝酸具有强氧化性,它能和许多物质发生反应.写出浓硝酸与非金属单质碳的反应方程式.______.配平下列
1986年 人们成功的用如下反应制得了氟:①2KMnO4+2KF+10HF+3H2O2=2K2MnF
1986年,人们成功的用如下反应制得了氟:①2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2②K2MnF6+2SbF5=2KSbF6+MnF4③2MnF4=2MnF3+F2↑。下列说法中正确的是A
高铁酸钾是一种理想的绿色水处理剂 工业上可通过如下反应制得:Fe(OH)3+ClO-+OH-一FeO
高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:Fe(OH)3+ClO-+OH-一FeO42-+Cl-+H2O(未配平),在上述反应中( )A.FeO42-是还原产
下列物质与水反应不属于氧化还原反应的是A.NO2B.CaOC.Cl2D.Na2O2
下列物质与水反应不属于氧化还原反应的是A.NO2B.CaOC.Cl2D.Na2O2












