将m g的铜放入足量的稀硝酸中充分反应后 生成n L(标准状况)一氧化氮 被还原的硝酸为( )①
| 将m g的铜放入足量的稀硝酸中充分反应后,生成n L(标准状况)一氧化氮,被还原的硝酸为( ) ①63n/22.4 g; ②n/22.4 g; ③m/96 mol; ④42m mol
|
参考解答
| B |
试题分析:铜和稀硝酸的反应方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 可以看到:被还原的硝酸的物质的量等于一氧化氮的物质的量即n(HNO3)被还原=n(NO)=n/22.4 mol ; 所以m(HNO3)被还原='63n/22.4' g;从铜和被还原的硝酸是定量关系得: 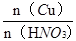 = =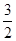 所以n(HNO3)被还原='m/96' mol 故选B。 所以n(HNO3)被还原='m/96' mol 故选B。点评:本题考查的是铜和硝酸反应的计算,铜和硝酸的反应需要注意其间定量关系,尤其是是做氧化剂的部分。 |
相似问题
实验室中所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O(1)
实验室中所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O(1)该反应既是离子反应也是氧化还原反应。该反应的还原剂是(用化学式表
已知在高温下可以发生反应:4FeS2 + 11O2 = 2Fe2O3+8SO2 FeS2中硫为 -
已知在高温下可以发生反应:4FeS2 + 11O2 = 2Fe2O3+8SO2 ,FeS2中硫为 -1价。该反应的氧化产物和还原产物的质量比为()A.1:1B.1:4C.4:11D.4:1
a mol Cu与含b mol HNO3的溶液恰好完全反应 被还原的HNO3的物质的量一定是(
a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是( )A.(b-2a) molB. molC. molD. mol
高铁酸钾(K2FeO4)是一种新型 高效 多功能水处理剂 其与水的离子反应是4FeO42-+10H2
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后
向100 mL FeBr2溶液中通入标准状况下的Cl2 3.36 L Cl2全部被还原 最终测得溶液
向100 mL FeBr2溶液中通入标准状况下的Cl2 3 36 L,Cl2全部被还原,最终测得溶液中c(Br-)是c(Cl- )的一半,则原FeBr2溶液的物质的量浓度(mol·L-1)是A.0 75B.1 5C.2D.3












