a mol Cu与含b mol HNO3的溶液恰好完全反应 被还原的HNO3的物质的量一定是(
a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是( )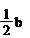 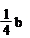 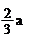
|
参考解答
| A |
| 根据原子守恒可知,生成硝酸铜是amol,所以没有被还原的硝酸是2amol,因此被还原的硝酸是(b-2a) mol ,答案选A。 |
相似问题
高铁酸钾(K2FeO4)是一种新型 高效 多功能水处理剂 其与水的离子反应是4FeO42-+10H2
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后
向100 mL FeBr2溶液中通入标准状况下的Cl2 3.36 L Cl2全部被还原 最终测得溶液
向100 mL FeBr2溶液中通入标准状况下的Cl2 3 36 L,Cl2全部被还原,最终测得溶液中c(Br-)是c(Cl- )的一半,则原FeBr2溶液的物质的量浓度(mol·L-1)是A.0 75B.1 5C.2D.3
(2分)配平方程式: Zn + HNO3— Zn(NO3)2 + N2 + H2O
(2分)配平方程式: Zn + HNO3— Zn(NO3)2 + N2 + H2O
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中 加热少许时间后溶液中形成Na
将一定量的氯气通入30mL浓度为10 00mol L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )A.与NaOH反
在100mL FeI2溶液中缓缓通入标准状况下的氯气3.36L 反应完全后 溶液中有一半的Fe2+被
在100mL FeI2溶液中缓缓通入标准状况下的氯气3 36L,反应完全后,溶液中有一半的Fe2+被氧化生成Fe3+。则原来FeI2溶液的物质的量浓度为()A.1 mol·L-












