实验室可由软锰矿(主要成分为MnO2)制备KMnO4 方法如下:高温下使软锰矿与过量KOH(s)和K
| 实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。 请回答: (1)用软锰矿制备K2MnO4的化学方程式是 。 (2)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。生成0.1mol还原产物时转移电子 个。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是 。 (3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2。若取用软锰矿制得的KMnO4产品0.165g,能与0.335g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为 。 |
参考解答
(1)6KOH + KClO3 + 3MnO2 →3 K2MnO4 + KCl + 3H2O;(1分×2) (2)1:2(1分)、 0.2NA或6.02×10-22(1分)、 KMnO4 >K2MnO4 >MnO2(2分) (3)0.958(2分) |
试题分析: (1)反应物为KOH、KClO3、MnO2,生成物为K2MnO4(锰酸钾)和KCl、水,该反应为6KOH+KClO3+3MnO2═3K2MnO4+KCl+3H2O, 故答案为:6KOH+KClO3+3MnO2═3K2MnO4+KCl+3H2O; (2)K2MnO4转化为KMnO4的反应中K2MnO4→2KMnO4+MnO2,Mn元素的化合价由+6价升高为+7价,Mn元素的化合价由+6价降低为+4价,则氧化剂和还原剂的物质的量之比为1:2,生成0.1mol还原产物时转移电子0.1mol×(6-4)××NA=0.2NA或6.02×10-22,由氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,可知氧化性为KMnO4>K2MnO4>MnO2,故答案为:1:2;0.2NA或6.02×10-22;KMnO4>K2MnO4>MnO2; (3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2,设KMnO4的纯度为x,则由电子守恒可知, 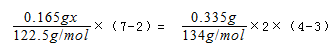 解得x=0.958,故答案为:0.958. |
相似问题
在一定条件下 可发生反应:RO3n-+F2+2OH-==RO4-+2F-+H2O。则RO3n-中R元
在一定条件下,可发生反应:RO3n-+F2+2OH-==RO4-+2F-+H2O。则RO3n-中R元素的化合价是A.+4B.+5C.+6D.+7
含化合价为+5价的A元素的某氧化剂被亚硫酸钾还原 如果有0.003摩+5价的A元素被还原为较低价态
含化合价为+5价的A元素的某氧化剂被亚硫酸钾还原,如果有0 003摩+5价的A元素被还原为较低价态,需用0 5mol L的亚硫酸钾溶液15ml,则A元素被还原后的化合
过量铁粉与稀硝酸反应的方程式为:3Fe + 8HNO3 (稀)= 3Fe(NO3)2 +
过量铁粉与稀硝酸反应的方程式为:3Fe + 8HNO3 (稀)= 3Fe(NO3)­2 + 2NO↑ + 4H2O①标出电子转移的方向和数目② 该反应的氧化剂是,还原产物
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+a OH-=Y++2H2O
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+a OH-=Y++2H2O下列说法中,不正确的是()A.S2O32-是还原剂B.Y的化学式为Fe2O3C.a
(8分)某一反应体系有反应物和生成物共五种物质:O2 H2CrO4 Cr(OH)3 H2O H2O2
(8分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2 → O2(1)写出该反应的化学












