过量铁粉与稀硝酸反应的方程式为:3Fe + 8HNO3 (稀)= 3Fe(NO3)­2 +
| 过量铁粉与稀硝酸反应的方程式为: 3Fe + 8HNO3 (稀)= 3Fe(NO3)2 + 2NO↑ + 4H2O ① 标出电子转移的方向和数目 ② 该反应的氧化剂是 ,还原产物是 ; ③ 标准状况下,当生成2.24L NO气体时, 有 g Fe参加反应,转移的电子总数为个,有 mol氧化剂被还原。 |
参考解答
① 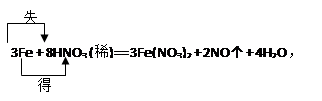 ② HNO3,NO ③8.4,0.3NA,0.1 |
试题分析:反应中Fe由0价升为+2价,每3molFe反应,失6mole-。N由+5价降为+2价,每生成2molNO转移6mole-。还原剂是Fe、氧化剂是硝酸、氧化产物是硝酸亚铁、还原产物是NO。每生成1molNO,有1.5molFe反应,转移3mole-,有1molHNO3被还原。 点评:氧化还原反应中,还原剂失电子、被氧化、生成氧化产物;氧化剂得电子、被还原、生成还原产物。 |
相似问题
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+a OH-=Y++2H2O
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+a OH-=Y++2H2O下列说法中,不正确的是()A.S2O32-是还原剂B.Y的化学式为Fe2O3C.a
(8分)某一反应体系有反应物和生成物共五种物质:O2 H2CrO4 Cr(OH)3 H2O H2O2
(8分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2 → O2(1)写出该反应的化学
在KClO3+6HCl=KCl+3Cl2+3H2O反应中 当生成0.5molCl2时 氧化产物和还原
在KClO3+6HCl=KCl+3Cl2+3H2O反应中,当生成0 5molCl2时,氧化产物和还原产物的物质的量之比为( )A.6:1B.5:1 C.1:3D.1:5
有一稀硫酸和稀硝酸的混合酸 其中H2SO4和HNO3的物质的量浓度分别是4 mol/L和2 mol/
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol L和2 mol L,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生
钙是自然界存在最广泛的IIA族元素 常以化合物N存在。从钙单质起始发生的一系列化学反应可由下图表示:
钙是自然界存在最广泛的IIA族元素,常以化合物N存在。从钙单质起始发生的一系列化学反应可由下图表示:(1)钙元素在周期表中位于第______周期;Y中存在的












