(15分)下表中列出五种短周期元素X Y Z W T的信息。元素相关信息X基态原子最外层电子排布为n
(15分)下表中列出五种短周期元素X、Y、Z、W、T的信息。
回答下列问题: (1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是 (用离子符号表示);T元素的基态原子核外电子排布式为 。 (2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有 ,晶体类型为 。 (3)T元素的最高价氧化物对应水化物的化学式是 H2Y的沸点比H2W高的原因是 。 (4) Z2 WY3溶液呈 性,其原因是(用离子方程式表示) 。 (5)已知25℃、101 kPa下: ①2Z(s)+ 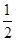 Y2(s)=Z2Y(s) △H1=-414KJ/mol Y2(s)=Z2Y(s) △H1=-414KJ/mol②2Z(s)+ Y2(s)=Z2Y2(s) △H1=-511KJ/mol 则1mol Z2 Y2(S)与足量Z(s)反应生成Z2 Y(s)的热化学方程式为 。 |
参考解答
(1)Na+<O2-<S2-;1s22s22p63s23p5或【Ne】3s23p5;(2)离子键、共价键;离子晶体;(3)HClO4,水分子间易形成氢键;(4)碱,SO32-+H2O HSO3-+OH-,HSO3-+H2O HSO3-+OH-,HSO3-+H2O H2SO3+OH-; H2SO3+OH-;(5)Na2O2(s)+2Na(s)=2Na2O(s) ?H= -317KJ/mol |
| 试题分析:根据题意可知:X是N;Y是O;Z是Na;W是S;T是Cl。(1)Na+、O2-的核外电子排布是2、8;而S2-的核外电子排布是2、8、8.对于电子层结构相同的微粒来说,核电荷数越大,离子半径就越小,对于电子层结构不同的微粒来说,电子层数越多,离子半径就越大。故离子半径由小到大的顺序是Na+<O2-<S2-;17号元素Cl元素的基态原子核外电子排布式为1s22s22p63s23p5或【Ne】3s23p5;(2)N与Na两元素可形成化合物NaN3,其晶体中化学键类型有离子键、共价键;其晶体类型为离子晶体;(3)Cl元素的最高价氧化物对应水化物的化学式是HClO4,H2O的沸点比H2S高是因为在水的分子之间存在氢键,增加了分子之间的相互作用。(4) Na2SO3是强碱弱酸盐,水解使溶液呈碱性。水解的两种方程式是SO32-+H2O  HSO3-+OH-,HSO3-+H2O HSO3-+OH-,HSO3-+H2O H2SO3+OH-;①×2-②,整理可得Na2O2 (s) +2Na(s)=2Na2O(s) ?H= -317KJ/mol。 H2SO3+OH-;①×2-②,整理可得Na2O2 (s) +2Na(s)=2Na2O(s) ?H= -317KJ/mol。 |
相似问题
已知原子序数 可推断原子的( )①质子数 ②中子数 ③质量数 ④核电荷
已知原子序数,可推断原子的( )①质子数②中子数③质量数④核电荷数⑤核外电子数⑥原子结构示意图⑦元素在周期表中的位置A.①②③④⑥B.①④⑤⑥⑦C.
下列说法中 正确的是A.第ⅠA族元素都比第ⅡA族元素金属性强B.只含有非金属元素的化合物可能是离子化
下列说法中,正确的是A.第ⅠA族元素都比第ⅡA族元素金属性强B.只含有非金属元素的化合物可能是离子化合物C.只含有共价键的物质一定是共价化合物D.同
(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下
(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示,元素8O16S34Se52Te单质熔点(℃)-218 4113
短周期元素甲 乙 丙 丁的原子序数依次增大 甲和乙形成的气态化合物的水溶液呈碱性 乙位于第VA族 甲
短周期元素甲,乙,丙,丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则 (
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是A.微粒X2-与Y2+核
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是A.微粒X2-与Y2+核外电子排布相同,离子半径:X2-> Y2+B.人们可在周












