(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下
(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示,
(1)单质硒的熔点范围可能是________________。 (2)元素碲的主要化合价可能有________________。 (3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________________(用化学式表示)。 (4)氢硒酸有较强的__________(填“氧化性”或“还原性”),因此露置在空气中长期保存易变质,其可能发生反应的化学方程式为_________________________________。 (5)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族元素中某一元素的单质,纵坐标为相同物质的量的单质与H2反应过程中的能量变化(能量变化>0表示放热,能量变化<0表示吸热)。则:b代表___________ _____, d代表 (均写单质名称)。 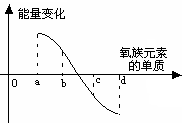 | ||||||||||||||||||||||||||||||
参考解答
| (1)大于113℃,小于450℃(1分) (2)-2,+4,+6 (1分) (3)H2Te>H2Se>H2S (2分) (4)还原性(1分),2H2Se+O2==2Se+2H2O(2分) (5)硫(1分),碲(1分)。 |
试题分析:(1)根据在氧族元素中单质熔点的变化从8O到52Te逐渐升高的规律中得到。 (2)在同一主族中元素的主要化合价相同故碲的主要化合价可能有-2,+4,+6。 (3)在同一主族中,元素原子序数越大,元素的非金属性越弱,形成的氢化物的稳定性越差,氢化物水溶液的酸性越强,故硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是H2Te>H2Se>H2S。 (4)在同一主族中,形成的简单阴离子的还原性随原子序数增大而增强,故氢硒酸有较强的还原性。 (5)在此反应过程中放出的能量越多氢化物的稳定性越强,得到a的氢化物最稳定,d的氢化物稳定性最差,可得。 |
相似问题
短周期元素甲 乙 丙 丁的原子序数依次增大 甲和乙形成的气态化合物的水溶液呈碱性 乙位于第VA族 甲
短周期元素甲,乙,丙,丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则 (
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是A.微粒X2-与Y2+核
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是A.微粒X2-与Y2+核外电子排布相同,离子半径:X2-> Y2+B.人们可在周
两种元素原子的核外电子层数之比与最外层电子数之比相等 则在周期表的前10号元素中 满足上述关系的元素
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有 ( )A.1对B.2对C.3对D.4对
(10分).Ⅰ. 下表列出了A~R 9种元素在周期表中的位置(填元素符号):主族周期ⅠAⅡAⅢAⅣA
(10分) Ⅰ 下表列出了A~R 9种元素在周期表中的位置(填元素符号):主族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA02EF3ACDGR4BH(1)这9种元素中化学性质最不活泼的
W X Y Z均是短周期元素 X Y处于同一周期 X Z的最低价离子分别为X2-和Z- Y+和Z-
W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )A.原子最外












