(14分)下表列出了A—R九种元素在周期表中的位置 用元素符号或化学式填空。 主族周期ⅠAⅡAⅢAⅣ
(14分)下表列出了A—R九种元素在周期表中的位置,用元素符号或化学式填空。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是 。 (3)A、B、C三种元素按原子半径由大到小的顺序排列的为 。 (4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是 。 (5)H元素跟A元素形成的化合物的化学式是 ;A2F2的电子式是 ;。 (6)B和F两种元素形成的2:1型化合物属于 (填“离子化合物”或“共价化合物”),请用电子式表示其形成过程 。 (7)国际无机化学命名委员会在1989年作出决定, 把元素周期表的主、副族及其族号取消, 由左至右改为1~18列。按这个规定,第15列元素应为 族元素,其简单氢化物的化学式为 (用字母“M”表示该族元素) |
参考解答
| (1) Ar; K; KOH; HClO4。 (2) Al(OH)3+OH-=AlO2-+2H2O。(3) K>Na>Mg (4) 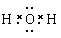 ; HCl>HBr。 (5) NaBr; ; HCl>HBr。 (5) NaBr;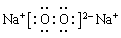 。 。(6) 离子化合物  ;(7) ⅤA ; MH3。 ;(7) ⅤA ; MH3。 |
试题分析:根据元素在周期表中的位置可知:A是Na;B是K;C是Mg;D是Al;E是C;F是O;G是Cl;H是Br;R是Ar。(1)这九种元素中:化学性质最不活泼的是Ar;金属性最强的是K;最高价氧化物的水化物碱性最强的碱是KOH;最高价氧化物的水化物酸性最强的酸是HClO4。(2)Al2O3是两性氧化物,既能与强酸反应产生盐和水,也能与强碱反应产生盐和水。Al2O3与NaOH反应的化学方程式是:Al2O3+2NaOH=2NaAlO2+2H2O,离子方程式是:Al2O3+ 2OH-= 2AlO2-+ H2O。(3)Na、K是同一主族的元素,由于电子层数:K>Na,所以原子半径K>Na;Na、Mg是同一周期的元素。原子序数越大,原子半径就越小。所以原子半径Na>Mg。因此原子半径:K>Na>Mg。(4)F是O,它形成的氢化物H2O是根据化合物,其电子式为 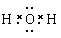 。同一主族的元素,元素的非金属性越强,对应的氢化物的稳定性就越强。由于Cl、Br是同一主族的元素,由于非金属性Cl>Br.所以氢化物的稳定性HCl>HBr。(5)Br元素跟Na元素形成的化合物的化学式是NaBr,Na2O2的电子式是 。同一主族的元素,元素的非金属性越强,对应的氢化物的稳定性就越强。由于Cl、Br是同一主族的元素,由于非金属性Cl>Br.所以氢化物的稳定性HCl>HBr。(5)Br元素跟Na元素形成的化合物的化学式是NaBr,Na2O2的电子式是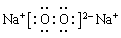 .(6)K和O两种元素形成的2:1型化合物K2O属于离子化合物,用电子式表示其形成过程为 .(6)K和O两种元素形成的2:1型化合物K2O属于离子化合物,用电子式表示其形成过程为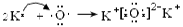 。(7) 按这个规定,第15列元素应为ⅤA ;由于其最外层有5个电子,要达到8的电子的稳定结构少三个电子,所以其简单氢化物的化学式为MH3。 。(7) 按这个规定,第15列元素应为ⅤA ;由于其最外层有5个电子,要达到8的电子的稳定结构少三个电子,所以其简单氢化物的化学式为MH3。 |
相似问题
(8分)A B C D E F为原子序数依次增大的短周期元素 B C相邻且同周期 A D同主族。C原
(8分)A、B、C、D、E、F为原子序数依次增大的短周期元素,B、C相邻且同周期,A、D同主族。C原子最外层电子数是核外电子层数的3倍,A、C能形成两种化合物
是重要的核工业原料 但在自然界的丰度很低 的浓缩一直为国际社会关注。下列有关:说法正确的是A.与
是重要的核工业原料,但在自然界的丰度很低,的浓缩一直为国际社会关注。下列有关:说法正确的是A.与互为同位素B.原子核外有143个电子C:与是同一种核
短周期元素 X 和 Y 可以形成 XY4型化合物 若 X 的原子序数为 m Y 的原子序数为
短周期元素 X 和 Y 可以形成 XY4型化合物, 若 X 的原子序数为 m , Y 的原子序数为 n , 则 m 和n 的相互关系不可能为A.m – 13 = nB.n + 5 = mC.m + 8 = nD.n – 11 = " m "
如下图所示为各元素周期表中的一部分 表中数字是原子序数 其中X为35的是( )
如下图所示为各元素周期表中的一部分,表中数字是原子序数,其中X为35的是( )
【化学——选修3:物质结构与性质】(15分) 人类文明的发展历程 也是化学物质的认识和发现的历程 其
【化学——选修3:物质结构与性质】(15分) 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯


 主族
主族









