[化学—选修3物质结构与性质](15分)卤族元素的单质和化合物很多 我们可以利用所学物质结构与性质的
| [化学—选修3物质结构与性质](15分) 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。 (1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。 (2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。 (3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
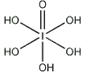 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”) )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为_____,孤电子对对数为______, I3-离子的空间构型为___________。 与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。 A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2 (6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。 (7)下图为碘晶体晶胞结构。有关说法中正确的是_____________。 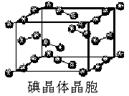 A.碘分子的排列有2种不同的取向,2种取向不同 的碘分子以4配位数交替配位形成层结构 B.用均摊法可知平均每个晶胞中有4个碘原子 C.碘晶体为无限延伸的空间结构,是原子晶体 D.碘晶体中的碘原子间存在非极性键和范德华力 (8)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。 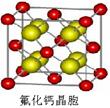 |
参考解答
| (15分) (1)p;4s24p5 (2)氢键 (3)碘 (4)< (5)2,3,直线型,A (6)sp3杂化,Cl2O、OF2、BrO2-等 (7)AD (8) 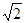 ρNAa3/2. ρNAa3/2. |
试题分析:(1)根据卤族元素的最外层电子排布的最后一个轨道判断,卤族元素位于周期表的p区;溴是第四周期元素,最外层7个电子,所以价电子排布式为4s24p5 (2)HF分子间存在氢键,使氢氟酸是以二分子缔合(HF)2形式存在的; (3)第一电离能越小,形成的离子越稳定,卤族元素中碘的第一电离能最小,所以碘最有可能生成较稳定的单核阳离子; (4)根据同种元素形成的含氧酸的酸性判断依据,将酸写成(HO)mROn,n值越大,酸性越强。H5IO6与HIO4写成该形式后,HIO4中的n值较大,酸性较强,所以:H5IO6<HIO4。 (5)I3-离子的中心原子周围σ键电子对对数的判断把其中一个I当作是中心原子,另2个与其形成共价键,所以I3-离子的中心原子周围有2个σ键,σ键电子对对数是2对;根据价层电子对互斥理论,孤电子对对数='1/2(7+1-2×1)=3,' I3-离子的空间构型是直线型;CsCl与CsI相比,氯离子半径小于碘离子半径,离子半径越小,晶格能越大,所以前者的晶格能较大,则按A式发生; (6)ClO2-中心氯原子周围有四对价层电子,根据杂化轨道理论判断氯原子的杂化轨道类型为sp3杂化;ClO2-是3原子20个价电子的粒子,与它是等电子体的微粒有Cl2O、OF2、BrO2-等; (7)A、根据晶胞结构判断碘分子的排列有2种不同的取向,分别是顶点和面的中心,每种取向的碘分子与同层相同取向的碘分子距离最近且相等的都是4个碘分子,所以2种取向不同的碘分子以4配位数交替配位形成层结构,正确;B、用均摊法可知平均每个晶胞中有4个碘分子,8个碘原子,错误;C、碘晶体为无限延伸的空间结构,但不是网状结构,不是原子晶体,是分子晶体,错误;D、碘分子中的碘原子间是非极性键,碘分子间的碘原子之间是范德华力,正确,答案选AD; (8)图中黄球是8个,红球是4个,所以红球代表Ca2+,相邻的两个Ca2+即顶点与面心的钙离子,核间距为acm,则晶胞的边长是 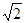 acm,设CaF2的相对分子质量为M,则ρ=4M/NA÷( acm,设CaF2的相对分子质量为M,则ρ=4M/NA÷(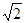 a)3,所以M= a)3,所以M=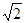 ρNAa3/2. ρNAa3/2. |
相似问题
〔化学—选修3:物质结构与性质〕(15分)早期发现的一种天然准晶颗粒由三种Al Cu Fe元素组成。
〔化学—选修3:物质结构与性质〕(15分)早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:(1)准晶是一种无平移周期序,但有严格准
下列与OH—具有相同的质子数和电子数的微粒是( )A.CH4B.NH4+C.Cl—D.NH2—
下列与OH—具有相同的质子数和电子数的微粒是( )A.CH4B.NH4+C.Cl—D.NH2—
已知A B C D E F G位于元素周期表的前四周期 且元素原子序数依次增加 A焰色反应呈黄色;工
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和Na
图A所示的转化关系中(具体反应条件略) a b c和d分别为四种短周期元素的常见单质 其余均为它们的
图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶
碱金属元素在科学研究与生产生活中有着非常广泛的用途。(1)锂是最轻的金属 如果用锂做一架飞机 两个
碱金属元素在科学研究与生产生活中有着非常广泛的用途。(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如图所示












