〔化学—选修3:物质结构与性质〕(15分)早期发现的一种天然准晶颗粒由三种Al Cu Fe元素组成。
| 〔化学—选修3:物质结构与性质〕(15分) 早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题: (1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。 (2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为 (3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。 (4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果) |
参考解答
(1)X射线衍射;(2)4个;血红色;(3)sp3;sp2;6NA;乙酸的分子间存在氢键,增加了分子之间的相互作用;16;(4)12;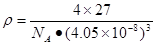 |
试题分析:(2)从外观无法区分三者,但是用X光照射会发现:晶体会对x射线发生衍射,而非晶体不会对x射线发生衍射。准晶体介于二者之间。因此通过有无衍射现象即可确定。(2)26号元素Fe核外电子排布是1s22s22p63s23p63d64s2,即可见在基态Fe原子上有4个个未成对的电子,当Fe原子失去4s的2个电子后,再失去1个3d电子就得到了Fe3+. 因此Fe3+的电子排布式是1s22s22p63s23p63d5. Fe3+与SCN-形成的多种配位化合物的颜色但是血红色的。可利用这一性质来检验Fe3+。(3)新制的Cu(OH)2在加入时可将乙醛(CH3CHO)氧化为乙酸,而它自身则被还原为砖红色的Cu2O。反应的方程式是:CH3CHO+ 2Cu(OH)2=CH3COOH+Cu2O↓+2H2O。在分子乙醛中,甲基碳原子的杂化轨道类型为上是sp3杂化 ;而醛基上碳原子是sp2杂化;乙酸的沸点明显高于乙醛,其主要原因是 乙酸的相对分子质量比乙醛大,而且在分子间存在氢键,增加了分子之间的相互作用,所以沸点比乙醛高。在Cu2O的一个晶胞中含有的O原子的个数是:4+8×1/8+6×1/2=8.由于Cu:O=2:1.因此在一个晶胞中含有的Cu原子的个数是16个。(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,而通过一个顶点可以形成8个晶胞,由于每个面重复数了2次,所以在晶胞中原子的配位数为(3×8)÷2=12.在一个晶胞中含有的Al原子的个数是8×1/8+6×1/2=4.因此Al单质的密度 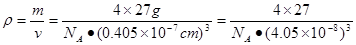 g/cm3. g/cm3. |
相似问题
下列与OH—具有相同的质子数和电子数的微粒是( )A.CH4B.NH4+C.Cl—D.NH2—
下列与OH—具有相同的质子数和电子数的微粒是( )A.CH4B.NH4+C.Cl—D.NH2—
已知A B C D E F G位于元素周期表的前四周期 且元素原子序数依次增加 A焰色反应呈黄色;工
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和Na
图A所示的转化关系中(具体反应条件略) a b c和d分别为四种短周期元素的常见单质 其余均为它们的
图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶
碱金属元素在科学研究与生产生活中有着非常广泛的用途。(1)锂是最轻的金属 如果用锂做一架飞机 两个
碱金属元素在科学研究与生产生活中有着非常广泛的用途。(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如图所示
根据原子结构及元素周期律的知识 下列推断正确的是A.同主族元素含氧酸的酸性随核电荷数的增加而减弱B.
根据原子结构及元素周期律的知识,下列推断正确的是A.同主族元素含氧酸的酸性随核电荷数的增加而减弱B.核外电子排布相同的微粒化学性质也相同C.Cl ̄、












