取含MnO2的软锰矿石27.86g 跟足量浓盐酸反应 制得5.6L氯气(该状态下Cl2密度为3.17
| 取含MnO2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2密度为3.17g/L)计算: (1)这种软锰矿石中MnO2的质量分数? (2)被氧化的HCl为多少g? |
参考解答
| (1)78.1% (2)18.25 |
试题分析:解:(1)设该27.86g含有的MnO2的质量为x,被氧化的HCl的质量为y,根据 MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ 87 146 71 x y 3.17×5.6=17.752g 即 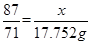 ,解得 ,解得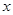 =21.752, =21.752,所以这种软锰矿石中MnO2的质量分数=21.752/27.86×100%='78.1%' ; 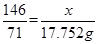 解得y=36.50g,即参加反应的HCl为36.50g, 解得y=36.50g,即参加反应的HCl为36.50g,即被氧化的HCl=1/2×36.50=18.25g。 点评:本题考查了化学反应方程式的简单计算,该题难度适中,但是要注意5.6L的氯气并不是在标准状况下的。 |
相似问题
在反应3S+6KOH=2K2S+K2SO3+3H2O中 被还原的硫与被氧化的硫的质量比为( )A.
在反应3S+6KOH=2K2S+K2SO3+3H2O中,被还原的硫与被氧化的硫的质量比为()A.2:1B.1:2C.3:1D.1:3
多硫化钠Na2Sx(x≥2)在结构上与Na2O2 FeS2 CaC2等有相似之处。Na2Sx在碱性溶
多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物
已知M2O7x-+3S2-+14H+ =2M3++3S↓+7H2O 则M2O7x-中的M的化合价为(
已知M2O7x-+3S2-+14H+ =2M3++3S↓+7H2O,则M2O7x-中的M的化合价为()A.+2B.+3C.+4D.+6
向某FeBr2溶液中 通入1.12L(标准状况)的Cl2 测得溶液中c(Br-)=3c(Cl-)=0
向某FeBr2溶液中,通入1 12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0 3mol L。反应过程中溶液的体积变化不计。则下列说法中正确的是A.原溶液的浓
(1)请完成该反应的离子方程式: C + MnO4- + H+ — CO
(1)请完成该反应的离子方程式:C +MnO4- +H+ — CO2↑+Mn2+ +H2O(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应












